유바이오로직스, 국내 두번째 코로나19 백신 3상 승인받을까
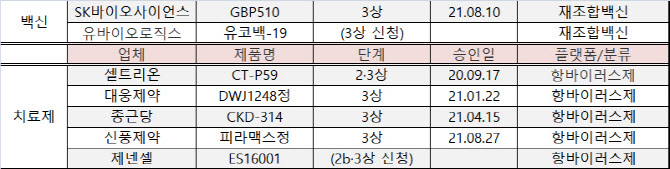
지난 8월10일 국내 개발 코로나19 백신으로는 처음으로 3상 임상시험을 승인받은 SK바이오사이언스(302440)에 이어 유바이오로직스가 12일 식품의약품안전처에 코로나19 백신 ‘유코백-19’의 제3상 임상시험 계획을 신청했다. 식약처가 임상을 승인하면 국내 백신으로는 두 번째로 임상 3상에 돌입하는 백신이 된다. 앞서 유바이오로직스는 지난달 17일 ‘유코백-19’ 임상 2상의 접종을 완료한 바 있다.
유코백-19는 SK바이오사이언스가 개발 중인 ‘GBP510’와 같은 합성항원 방식 백신이다. 유전자재조합 기술을 이용해 만든 항원 단백질을 면역증강제와 함께 주입해 면역반응을 유도하는 원리다. 독감이나 B형 간염 예방 접종 등에 활용된다. 개발 역사가 길어 안전성이 높은 편이고 2~8도 냉장에서 장기간 보관하는 점이 장점이다.
유바이오로직스 임상 3상은 건강한 성인 4000명을 대상으로 유코백-19를 2회 접종한 후 면역원성 및 안전성을 비교 평가하는 방식으로 진행된다. 대조 백신으로는 GBP510와 같은 아스트라제네카(AZ) 백신이 활용된다. SK바이오사이언스가 독주하는 코로나19 K백신 개발에 유바이오로직스가 도전장을 던질 여지를 남긴 셈이다.
|
머크 등장으로 바빠진 코로나19 치료제 개발
코로나19 치료제 분야에서는 새롭게 제넨셀이 제2b/3상 임상시험계획을 신청했다. 경구용 코로나19 치료제인 ‘ES16001’은 국내 자생 식물인 담팔수 잎에서 추출한 신소재 기반의 치료제 후보물질이다. 지난해 인도에서 임상 2상을 진행해 탐색적 유효성을 확인했다.
코로나19 치료제 개발이 더욱 긴박한 것은 머크의 코로나19 경구용 치료제가 게임체인저로 급부상했기 때문이다. 머크는 치료제 ‘몰누피라비르’ 긴급사용승인을 미국 FDA에 신청했다. 이르면 내달 초 결론이 날 것으로 보이는데 승인되면 최초의 코로나19 경구 치료제가 된다.
종근당과 대웅제약, 신풍제약은 다른 효과로 허가받은 의약품을 코로나19 치료제로 개발하는 ‘약물재창출’ 방식을 통해 개발에 나서고 있다. 종근당 ‘나파벨탄’은 췌장염 치료제고 대웅제약 코비블록은 만성췌장염 치료제다. 신풍제약 ‘피라맥스’는 말라리아 치료제로 활용된다.
제넨셀이 제2b/3상 임상을 신청한 ES16001은 바이러스의 감염과 복제를 저해하고 숙주세포 침입 및 재활성화를 억제한다. 코로나19 원인 바이러스인 ‘SARS-CoV2’의 RBD(바이러스-숙주세포 수용체 결합 영역) 결합 활성을 억제하고 증상을 완화할 것으로 기대되는 대목이다.








![[포토]은행권 소상공인 금융지원 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300609t.jpg)
![[포토]인사청문회 출석한 마은혁 헌법재판관 후보자](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300404t.jpg)
![[포토]아침 영하 10도, 꽁꽁 얼어붙은 도심](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300843t.jpg)
![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)


![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)


