AZ는 스위스 로슈의 크로발리맙과 노바티스의 ‘입타코판’ 등 현재 개발 중인 PNH 신약과 솔리리스의 바이오시밀러의 등장 시점 등에 촉각을 기울이고 있다. 삼성바이오에피스와 암젠 등이 각각 솔리리스 바이오시밀러의 임상 3상에 성공해, 저렴한 약가로 시장 진입을 예고한 상황이다. 하지만 새롭게 등장할 PNH 신약의 비교우위 장점으로 인해 바이오시밀러의 시장 경쟁력이 금세 잦아들 수 있다는 전망이 나온다.
|
AZ에 안긴 ‘솔리리스·울토미리스’ 세대교체 가속화
10일 제약바이오 업계에 따르면 지난해 10월 AZ는 솔리리스(성분명 에쿨리주맙)와 울토미리스(라불리주맙)를 보유한 희귀질환 전문 신약개발 기업 알렉시온을 390억 달러(당시 한화 약 42조원)에 인수했다. 이후 절차를 마무리한 AZ가 내달 본격적으로 관련 희귀질환 사업 본부를 가동할 전망이다. 국내에서 솔리리스와 울토미리스 등 2종의 판매를 담당하던 한독(002390) 역시 해당 품목을 AZ에 반납하게 됐다.
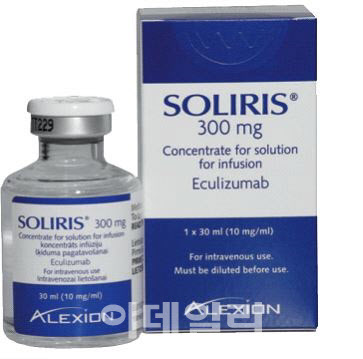
미국 식품의약국(FDA)으로부터 2007년 PNH 치료제로 승인된 솔리리스는 이후 한국을 포함한 50개국 이상에서 허가됐다. 여기에 해당 약물은 ‘비정형 용혈성 요독증후군’(aHUS), ‘전신 중증 근무력증’ 및 ‘시신경 척수염’ 등의 적응증을 추가로 획득했다. 솔리리스는 각각의 적응증에 승인된 최초의 치료제였다,
솔리리스는 수막구균 감염위험을 최대 2000배 이상 높인다는 것이 가장 큰 부작용으로 지적됐다. 이 때문에 해당 약물을 복용하는 환자는 수막구균 예방접종 주사를 맞아야 했다. 이 솔리리스의 특허는 2020년 유럽에서 만료됐다. 미국과 한국은 각각 2027년 3월과 2025년 2월에 특허가 끝났다.
삼성바이오로직스(207940) 관계사 삼성바이오에피스가 솔리리스 바이오시밀러 후보물질 ‘SB12’를 개발해, 지난해 6월 미국과 유럽에서 SB12의 시판허가 신청서를 제출했다. 암젠도 지난해 8월 관련 바이오시밀러인 ‘ABP959’의 임상 3상에 성공했다고 밝힌 바 있다.
이에 대비하기 위해 알렉시온이 개발한 솔리리스 후속작이 있다. 바로 2018년 미국에서 PNH 및 aHUS 등 2종의 적응증에 대해 승인된 ‘울토미리스’로 기전이나 부작용은 솔리리스와 엇비슷하다. 하지만 울토미리스는 8주의 1회 정맥주사하는 약물로 솔리리스(2주당 1회) 대비 투약 간격이 4배 길다. 두 약물을 사용하기 위해 환자가 병원에 방문해야 하는 만큼, 투여 간격은 가장 큰 경쟁력으로 평가된다.
|
시밀러 개발사 아닌 신약 개발 시도한 ‘로슈·노바티스’가 복병
이 때문에 업계에서는 현재 PNH 시장은 솔라리스나 관련 바이오시밀러가 아닌 투약간격 등에서 비교우위를 입증한 울토미리스와 차기 신약 후보인 크로발리맙 또는 입타코판 등이 주축이 될 것이란 관측이 나온다.
국내 바이오시밀러 개발 업계 관계자는 “30% 이상 저렴하게 바이오시밀러 들이 공급된다해도 솔리리스의 후속작인 울토미리스가 PNH 시장에서 전작보다 우수함을 인정받고 있다”며 “사실상 솔리리스 바이오 시밀러의 설 자리가 비교적 좁아진 상황이다. 울토미리스가 얻지 못한 솔리리스의 적응증과 관련한 시장을 좀더 집중적으로 노려볼 수는 있을 것”이라고 설명했다.
한편 지난 7일(현지시간) 로슈는 자사가 개발한 C5 타깃 항체 ‘크로발리맙’의 글로벌 임상 3상에서 4주의 1번씩 약물을 투여했음에도 솔리리스 대비 비열등성을 확인했다고 발표했다. 솔리리스 대비 2배 이상 투약 간격으로 크로발리맙의 허가 신청를 시도할 수 있게 된 셈이다.
이밖에도 노바티스가 지난해 10월 세계 최초 경구용 C5 억제제 입타코판의 임상 3상에서 솔리리스 및 울토미리스 대비 우월한 효능을 입증했다고 밝힌 바 있다. 입타코판은 1일 2회 투여하는 경구약으로 설계됐다. 앞선 관계자는 “입타코판이 시판에 성공할 경우 복용 편의성으로 PNH 시장을 압도할 수 있다”며 “울토미리스와 크로발리맙, 입타코판 등이 PNH 시장의 큰 축을 형성할 것”이라고 말했다.










![[포토] 원·달러 환율 오를까?](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900849t.jpg)
![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)
![[포토] 주식시장 활성화 테스크포스-경제계 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900547t.jpg)
![[포토]최재해, '정치적 탄핵 매우 유감...자진 사퇴 생각 없다'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900431t.jpg)
![[포토]'모두발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900370t.jpg)
![[포토]이데일리 퓨처스포럼 송년회 무대](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801622t.jpg)
![[포토]용산국제업무지구 개발계획 공동협약식에서 협약서 서명](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801123t.jpg)


![“신장 면화 안산다고? 유니클로 불매” 들끓는 中 민심[중국나라]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112901024b.jpg)

![[단독]의협, 전공의 투표 독려 위해 21억원 투입](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112901000h.jpg)