|
24일 관련 업계에 따르면 지난 18일 유한양행(000100)의 ‘렉라자정’(성분명 레이저티닙)이 국산 신약 31호로 등록됐다. 렉라자정은 지난 2018년 HK이노엔의 위식도 역류질환치료제 ‘케이캡정’(성분명 테고프라잔)이 30호로 허가를 받은 이후 약 3년 만에 나온 신약이라는 점에서 의미가 있다. 코로나19 사태로 연구개발(R&D) 활동이 주춤한데다 제약·바이오사들이 미국 시장을 노리고 처음부터 미국 식품의약국(FDA) 허가를 신청하는 경우가 많아져 국산 신약의 명맥이 다소간 끊겼었다.
하지만 올해는 렉라자정 이후에도 국산 신약 소식이 이어질 전망이다. 셀트리온(068270)은 코로나19 항체치료제 ‘렉키로나주’(성분명 레그단비맙, 코드명 CT-P59)는 조건부 허가를 신청하면서 국산 신약으로 등재도 요청한 것으로 알려졌다. 대웅제약(069620) 위식도역류질환 치료제 ‘펙수프라잔’은 지난 2019년 11월 국내 임상 3상을 마치고 신약으로 품목허가를 신청, 1년 이상 허가를 기다리고 있다. 한미약품(128940)의 호중구 감소증 치료제 ‘롤론티스’도 지난해 5월 품목허가를 신청한 만큼 연 내 허가 가능성이 나오고 있다.
|
HK이노엔의 케이캡정은 이들 뒤를 이어 연매출 1000억원을 올릴 신약으로 꼽힌다. 원외 처방액은 2019년 264억원에서 지난해 725억원으로 174% 급증했다. 전체 의약품 처방실적으로는 18위에 올랐다. 지난해 1, 2월 40억원대 수준이었던 처방실적은 9월 70억원을 기록한 이후 지속 증가 추세다. 이밖에 종근당의 당뇨병치료제 ‘듀비에’(성분명 로베글리타좀), 동아에스티의 당뇨병치료제 ‘슈가논정’(성분명 에보글립틴 타르타르산염) 등도 꾸준한 매출 성장을 보이고 있다.
신약 7개, 임상·개발 중단 등으로 허가 취소
|
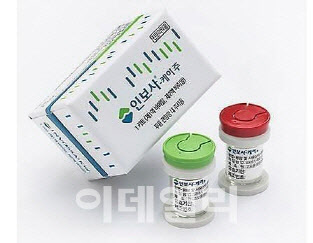
2019년에는 코오롱생명과학의 유전자치료제 ‘인보사케이주’가 퇴출됐다. 코오롱생명과학은 당초 인보사 허가 자료에 연골세포가 포함됐다고 기재했지만 종양을 유발할 수 있는 태아신장유래세포주가 삽입된 것으로 드러나면서 논란이 일었다. 식품의약품안전처는 코오롱생명과학이 자료를 허위로 작성해 제출했다고 판단해 허가 취소 결정을 내렸다.
2015년 허가를 받은 동아에스티의 ‘시벡스트로정’과 ‘시벡스트로주’의 경우 미국과 유럽에서는 출시됐지만 국내에서는 낮은 시장성 등을 이유로 출시되지 않았다. 결국 지난해 6월 허가를 자진 취하했다. 삼성제약이 국내 판권을 갖고 있는 카엘젬백스의 ‘리아백스’도 임상시험자를 확보하지 못하면서 지난해 8월 허가가 취소됐다.
제약업계 관계자는 “신약은 개발하는데도 오랜 시간과 비용이 들지만 막상 개발하고 나서도 기대만큼 많이 팔리지 않을 수 있어 제약사 입장에서는 많은 위험이 동반된다”면서도 “기술력을 인정받을 수 있고 꾸준히 매출을 일으키는 약도 있어 신약 개발은 중요한 부분”이라고 설명했다.










![[포토] 원·달러 환율 오를까?](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900849t.jpg)
![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)
![[포토] 주식시장 활성화 테스크포스-경제계 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900547t.jpg)
![[포토]최재해, '정치적 탄핵 매우 유감...자진 사퇴 생각 없다'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900431t.jpg)
![[포토]'모두발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900370t.jpg)
![[포토]이데일리 퓨처스포럼 송년회 무대](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801622t.jpg)
![[포토]용산국제업무지구 개발계획 공동협약식에서 협약서 서명](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801123t.jpg)

![강 건너고 짐도 나르고…‘다재다능’ 이상이의 무한변신 차는[누구차]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24113000161h.jpg)


