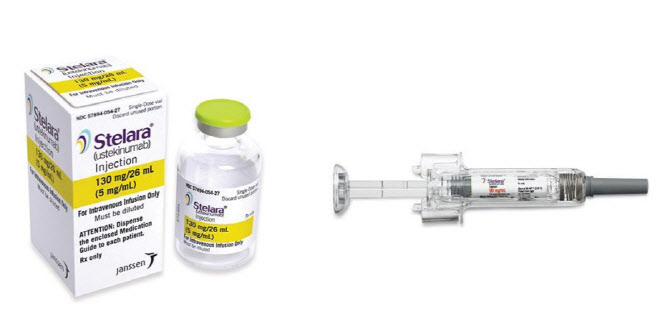
이번에는 2020년 기준 글로벌 시장 매출액이 79억4000만 달러(당시 한화 약 9조3692억원)로 전체 의약품 중 7위를 기록한 마국 제약사 얀센의 염증성 자가면역질환치료제 ‘스텔라라(성분명 우스테키누맙)’다.
|
스텔라라는 염증으로 인한 면역세포 활성에 영향을 주는 생체 신호 물질인 ‘인터류킨(IL)-12’과 ‘IL-23’을 동시에 타깃하는 단일클론항체다. 이 약물은 피하주사와 정맥주사 등 두 가지 제형으로 모두 개발됐다.
스텔라라는 크론병과 궤양성 대장염, 판상 건선, 건선 관절염 등 4종류의 염증성 자가면역질환 관련 적응증을 갖고 있다. 특히 크론병은 입에서 항문까지 이어진 소화기관 전체에서 발생할 수 있는 만성 염증성 자가면역질환이다. 이는 한국에서는 매우 드문 질환이었지만 최근 10여 년 사이 환자가 급증하고 있는 것으로 알려졌다.
국내외 시장에서 스텔라라의 가장 큰 경쟁 약물은 미국 제약사 애브비(AbbVie)가 개발한 ‘휴미라(성분명 아달리무맙)’다. 휴미라는 1세대 단일클론항체로 몸속 면역세포를 활성화하는 신호 물질 중 하나인 ‘혈액괴사인자알파(TNF-α)’를 비활성화(억제)한다. 이 약물은 미국 등 세계시장에서 류머티스관절염, 강직성 척추염 등 스텔라라 보다 약 4배 많은 총 15가지 적응증에 널리 사용되고 있다. 국내에서 휴미라는 총 12종의 적응증을 승인받았다.
휴미라는 2020년 기준 휴미라의 매출액은 204억 달러(22조 8300억원)였고, 전체 의약품 중 판매 1위를 차지한 바 있다. 업계에서는 국내외 여러 국가에서 휴미라와 같은 TNF-α 계열의 약물에 반응을 보이지 않는 환자에 스텔라라를 주로 쓰기 때문에 두 경쟁 약물의 매출액에서 큰 차이가 나는 것으로 분석한다. 결국 염증성 자가면역질환 관련 적응증의 1차 치료제로 휴미라를, 2차 치료제로 스텔라라가 널리 사용되고 있는 셈이다.
국내 바이오 기업들은 스텔라라의 특허 만료 시기에 맞춰 관련 바이오시밀러 제품을 출시하기 위해 잰걸음을 내고 있다.
먼저 셀트리온(068270)은 최근 관련 바이오시밀러 ‘CT-P43’를 가지고 판상 건선을 적응증으로하는 글로벌 임상 3상을 진행 중이다. 셀트리온은 올해 하반기 이번 임상 3상을 완료하는 것을 목표로 하고 있다.
동아에스티(170900)도 지난해 11월 스텔라라 바이오시밀러 ‘DMB-3115’의 글로벌 임상 3상 환자 등록을 완료한 것으로 알려졌다. 이번 임상 3상은 미국과 유럽 등에서 중증도에서 중증의 판상 건선 환자를 대상으로 하며, 올해 말까지 완료할 예정이다.
삼성바이오에피스도 폴란드와 체코 등 8개 국가에서 스텔라라의 바이오시밀러 ‘SB17’에 대한 글로벌 임상 3상을 진행하고 있다. 회사 측은 셀트리온이나 동아에스티보다 조금 늦은 2023년 3월까지 임상 3상을 완료할 계획이다.










![[포토]12월 LPG 국내 프로판 가격 인상](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100332t.jpg)
![[포토]초코과자 가격 상승](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100324t.jpg)
![[포토]점등 앞둔 사랑의 온도탑](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100312t.jpg)
![[포토]박찬대 “감액 예산안, 법정시한인 내일 본회의 상정”](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100294t.jpg)
![[포토]짙은 안개에 갇힌 도심](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100227t.jpg)

![[포토] 원·달러 환율 오를까?](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900849t.jpg)
![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)


![강풍에 체감온도 '뚝'…추위 속 흐리고 비[오늘날씨]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120200006h.jpg)