|
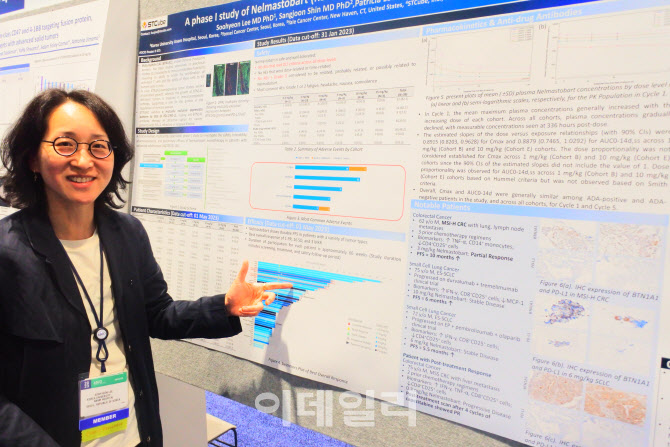
이수현 고려대 안암병원 혈액종양내과 부교수가 3일(현지시간) 미국 시카고에서 열린 ‘미국임상종양학회’(ASCO)에서 이같이 말했다. 이날 이 교수는 에스티큐브(052020)의 면역항암제 ‘넬마스토바트’ 임상 1상 중간 결과를 발표했다. 이 교수는 넬마스토바트의 국내 임상을 담당하고 있다.
넬마스토바트는 PD-1, PD-L1을 표적하는 대신 BTN1A1를 표적하는 면역항암제다. 키트루다·옵디보·티센트릭이 글로벌 50조원 매출에도 전체 암환자의 20~30%에서만 약 효능이 발현된다. 에스티큐브는 PD-1, PD-1 계열 면역항암제가 커버하지 못하는 암환자를 타깃으로 넬마스토바트를 개발 중이다.
이날 이데일리는 미국 시카고에서 열린 ASCO 현장을 찾아 국내 최초로 넬마스토바트 임상의를 대면 취재했다. 이 교수를 통해 넬마스토마트의 임상 1상 과정과 향후 전망에 대해 소상히 들어봤다,
“41주 연속 투약에도 독성 없어”
우선, 넬마스토바트의 무독성을 높게 평가했다. 이 교수는 “넬마스토바트는 독성이 없어 신경이 전혀 안쓰인다”면서 “투약 환자들도 전혀 불평하지 않는다”고 운을 뗐다. 이어 “넬마스토바트의 무독성과 투약 편의성 등으로 의사 입장에선 굉장히 마음이 편히 약을 처방한다”고 강조했다
넬마스토바트 투약자 가운데 이상반응을 나타낸 48명의 데이터를 공개했다. 이 중 43명은 두통, 피로, 메스꺼움, 식욕저하, 미열 등이었다. 나머지 5명의 이상 반응도 정도가 보통 수준의 2단계다. 극심한 이상반응을 나타내는 3단계를 보인 환자는 없었다.
그는 “사실 면역항암제 투약 환자들은 누적 독성이 나타난다”면서 “또, 면역체계 변화로 발생하는 문제가 있다”고 설명했다. 이어 “투약 시간도 30분~1시간으로, 48시간씩 맞는 화학항암제 대비 편하다”고 덧붙였다. 이 교수는 대장암 국내 환자 중 41주째 투약 중인 환자에게서 누적 독성 데이터가 전혀 나타나지 않았다고 부연했다.
임상을 통해 넬마스토바트의 우수한 효능이 확인됐다고 설명했다.
이 교수는 “소세포폐암의 무진행생존율(PFS)은 길어봐야 2개월”이라며 “넬마스토바토를 투약 중인 환자 2명 모두 6개월 넘게 무진행생존율을 보이고 있다”고 말했다.
구체적으로 소세포폐암을 앓는 75세 환자는 ㎏당 10㎎의 넬마스토바트 투약 후 암성장이 멈추면서 6개월 이상 무진행생존이 진행되고 있다. 또 다른 72세 소세포폐암 환자는 ㎏당 6㎎의 넬마스토바트 투약 후 암성장이 멈추며 5.5개월째 무진행생존을 기록했다. 이 데이터는 5월 1일 기준일이다. 현재까지 두 환자 모두 무진행생존이 이어지고 있다.
|
앞서 말한 41개월째 부분관해(PR)를 보인 62세 남성 대장암 환자는 2주 간격으로 3㎎/㎏ 넬마스토바트를 투약 중이다.
이 교수는 “40주 넘게 넬마스토바트 투약에도 내성없이 약물 효능이 지속 발현되고 있다”고 놀라워 했다. 해당 환자는 지난달 1일 기준 10개월째 무진행생존이 진행 중이다.
75세 남성 대장암 환자의 투약 결과 역시 놀랍다는 반응이다.
“넬마스토바트, 약효 지속...성공 가능성 높아”
이 교수는 넬마스토바트의 성공 가능성이 높다고 판단했다.
그는 “소세포폐암은 시스플라틴(1차 항암치료제)만 써도 엄청 효과가 크다”며 “투약 2주 만에 엑스레이에서 암세포가 거의 사라져 환자들이 감동하는 경우가 많다”고 말했다. 이어 “하지만 이들 대부분이 2달 뒤부터 급격히 예후가 나빠진다”고 덧붙였다.
기존 치료제가 지속성을 담보하지 못하는 것에 반해, 넬마스토바토는 약 효능이 지속된다.
그는 “화학항암제나 PD-L1 면역항암제는 빨리 성장하는 초기 암을 타깃으로 하는 경향이 있다”면서 “넬마스토바트는 느리게 자라는 암세포나, 저항성을 가진 암세포를 표적하는 경향을 나타냈다”고 임상 결과를 전했다.
넬마스토바토가 항암제 병용치료제로 가치가 높다고 결론이다. 그는 “넬마스토바토는 화학항암제 또는 PD-L1과 병용 치료제로 유용하단 판단”이라면서 “대장암 병용투여를 위해 치료제를 더 공급해달라고 회사에 요청했다”고 밝혔다.
이수현 교수는 45~50명 규모의 대장암 환자를 대상으로 넬마스토바트 연구자 임상을 올 하반기에 개시할 예정이라고 밝혔다. 해당 임상은 소세포폐암을 적응증으로 하는 넬마스토바트 미국 식품의약국(FDA) 임상 2상과는 별개로 진행된다.
그는 “넬마스토바트 1상은 BTN1A1 발현율과 무관하게 무려 16개 암종에서 환자를 받아 임상을 진행했다”면서 “넬마스토바트가 자체 개발한 진단키트를 통해 BTN1A1 발현율이 높은 환자를 선별할 경우, 객관적반응률(ORR)이 더 올라갈 수 있다”고 분석했다. 이어 “넬마스토바트는 임상 1상에서 안전성을 입증했고 효능이 확인됐다”면서 “병용투여 임상 2상에 대한 기대가 높다”고 덧붙였다.










![[포토] 원·달러 환율 오를까?](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900849t.jpg)
![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)
![[포토] 주식시장 활성화 테스크포스-경제계 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900547t.jpg)
![[포토]최재해, '정치적 탄핵 매우 유감...자진 사퇴 생각 없다'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900431t.jpg)
![[포토]'모두발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900370t.jpg)
![[포토]이데일리 퓨처스포럼 송년회 무대](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801622t.jpg)
![[포토]용산국제업무지구 개발계획 공동협약식에서 협약서 서명](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801123t.jpg)
![강 건너고 짐도 나르고…‘다재다능’ 이상이의 무한변신 차는[누구차]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24113000161h.jpg)



