뉴스 검색결과 4,299건
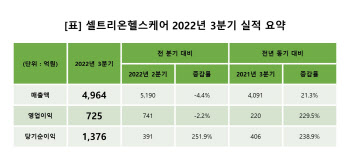
- 셀트리온헬스케어 3Q 영업익 725억원...전년比 230%↑
- (자료=셀트리온헬스케어)[이데일리 송영두 기자] 셀트리온헬스케어는 2022년 3분기 연결기준 매출액 4964억원, 영업이익 725억원, 당기순이익 1376억원을 기록했다고 밝혔다.매출액과 영업이익은 전년동기 대비 각각 21.3%, 229.5% 증가했다. 이는 피하주사제형 자가면역질환 치료제 램시마SC(성분명 인플릭시맙) 유럽 매출 증가, 아시아 및 중남미 등에서 램시마 및 허쥬마(성분명 트라스투주맙) 처방이 확대된 데 따른 것이다. 특히 수익성 좋은 램시마 및 램시마SC 판매가 확대되면서 영업이익이 대폭 증가했고, 전년 대비 개선된 14.6%의 영업이익률을 기록했다. 실적 개선을 이끈 램시마SC는 올 3분기까지 1500억원 이상의 매출을 기록해 3개 분기만에 지난해 연간 매출의 170%를 달성했다. 셀트리온헬스케어(091990) 관계자는 “코로나19 팬데믹 이후 환자 내원 치료 부담 완화 및 자가투여 편의성을 지닌 램시마SC만의 강점이 주목을 받으면서 처방 확대가 이뤄졌다”며 “듀얼포뮬레이션(Dual Formulation) 마케팅을 통해 램시마 처방도 함께 증가했다”고 말했다.의약품 시장조사기관인 아이큐비아(IQVIA)에 따르면 램시마 및 램시마SC는 올 2분기 독일에서 51%의 점유율을 기록해 2021년 대비 20%p 증가했다. 같은 기간 프랑스 56%, 영국 60% 점유율을 기록하는 등 처방 확대가 지속되고 있다. 핀란드, 체코 등 유럽 주요 5개국 외 지역에서도 램시마SC 처방이 확대되고 있는 만큼 향후 매출 성장도 지속될 것이라는 게 회사 측 설명이다.유방암, 위암 치료용 바이오시밀러 허쥬마 처방 확대도 실적 성장을 이끌었다. 허쥬마는 아시아, 중남미를 비롯한 글로벌 전역에서 처방이 확대되면서 매출이 전년 동기 대비 50% 이상 증가하는 성과를 달성했다.또한 유럽에서 판매 중인 휴미라 바이오시밀러 유플라이마(성분명 아달리무맙) 처방이 점진적으로 확대되고 있다. 전이성 직결장암 및 유방암 치료용 아바스틴 바이오시밀러 베그젤마(성분명 베바시주맙)도 출시 직후 핀란드 헬싱키 병원연합 입찰 수주에 성공하는 등 성과를 나타내며 기대를 모으고 있다. 올해 하반기부터 유럽에서 자체 유통 인프라를 통한 항암제 판매가 시작돼 실적 상승에 탄력이 붙을 것으로 보인다. 탄력적인 가격 전략이 가능해졌고, 출시 제품 및 지역 확대에 따른 포트폴리오 다각화로 해외 시장에서 경쟁력을 갖췄다는 평가다.셀트리온헬스케어 관계자는 “글로벌 주요 학회에서 확인된 바와 같이 당사 제품에 대한 현지 의료관계자들의 관심이 집중되고 있으며, 이러한 우호적인 분위기가 처방 확대에도 긍정적인 영향을 미치면서 전 지역에서 제품 판매 확대가 지속되고 있다”면서 ”제품 출시 지역이 점차 늘고 있고 유럽에서는 모든 제품으로 직판을 확대하며 경쟁력이 강화된 만큼 앞으로 더욱 적극적인 마케팅을 이어가면서 성과를 달성할 수 있도록 최선을 다할 것“이라고 말했다.

- 셀트리온, 3분기 매출 6456억원… 영업이익률 33.1%
- [이데일리 석지헌 기자] 셀트리온(068270)은 경영실적 공시를 통해 2022년 3분기 연결기준 매출액 6456억원, 영업이익 2138억원, 영업이익률 33.1%를 기록했다고 9일 밝혔다. 전년 동기 대비 매출액은 60.6%, 영업이익은 28.1% 증가했다.셀트리온 2공장 전경.(제공= 셀트리온)바이오시밀러 사업에서는 글로벌 성장세를 이어가고 있는 램시마의 공급 증가가 매출 확대에 주요인으로 작용했다는 설명이다. 이와 함께 다케다제약사로부터 자산권을 인수한 제품 중심으로 케미컬의약품 매출도 증대하면서 바이오의약품과 케미컬의약품 모두 고른 성장을 보였다. 셀트리온의 주요 바이오시밀러 제품군인 램시마, 트룩시마, 허쥬마는 유럽 자가면역질환 치료제 및 항암제 시장에서 안정적인 점유율을 유지하고 있다. 의약품 시장조사기관 아이큐비아(IQVIA)와 셀트리온헬스케어에 따르면 올해 2분기 유럽시장에서 램시마가 53.6%, 트룩시마 23.6%, 허쥬마가 12.7%의 시장 점유율을 기록했다. 의료정보 제공기관 심포니헬스(Symphony Health)에 따르면 화이자(Pfizer)를 통해 미국에서 판매중인 램시마(미국 판매명 인플렉트라)는 올해 3분기 기준 31.7%의 시장점유율을 기록하며 전년동기 대비 10.5%p 상승했다. 테바(Teva)를 통해 판매중인 트룩시마도 전년 동기 대비 3.8%p 상승한 27.6%의 점유율을 기록했다.램시마SC는 정맥주사(IV) 제형에서 피하주사(SC) 제형으로의 전환이 가속화되면서 독일에서 27%, 프랑스에서 16%의 점유율을 달성하는 등 유럽 주요 5개 국가 인플릭시맙 시장에서 점유율 10.7%를 기록했다. 셀트리온은 램시마SC가 유럽내 성장세를 등에 업고 미국에 출시될 때, 유럽과 마찬가지로 IV제형인 램시마와 SC 제형인 램시마SC가 함께 성장 시너지를 보여줄 것으로 보고 있다.셀트리온은 자가면역질환 치료제와 항암 항체 바이오시밀러에서 6개 제품 개발을 완료하고 5개의 후속 바이오시밀러의 임상 3상을 진행하며 포트폴리오 확장에 속도를 내고 있다. 지난 8월부터 유럽, 영국, 일본, 미국, 국내 등의 규제기관으로부터 아바스틴 바이오시밀러 베그젤마의 판매허가를 순차적으로 획득했으며, 베그젤마의 해외판매를 담당하는 셀트리온헬스케어는 최근 베그젤마를 영국과 독일에 출시했다. 이 외에도 스텔라라 바이오시밀러 CT-P43, 악템라 바이오시밀러 CT-P47, 아일리아 바이오시밀러 CT-P42, 졸레어 바이오시밀러 CT-P39, 프롤리아 바이오시밀러 CT-P41 등 5개의 바이오시밀러 제품이 현재 글로벌 임상 3상 진행중에 있다.셀트리온 관계자는 “이번 분기에는 바이오의약품과 케미컬의약품이 글로벌 시장에서 고르게 성장하며 매출과 영업이익 모두 전년 동기 대비 큰 폭으로 증가했다”며 “후속 바이오시밀러의 임상 및 개발도 차질없이 진행하고, 다양한 국내외 기업과의 협력을 통해 신약개발과 신성장동력 확보에도 최선을 다하겠다”고 했다.
- 극심한 통증의 ‘대상포진’ 미연에 방지하려면 예방접종부터
- [이데일리 이순용 기자] 30대 여성 A씨는 최근 몸에 띠 모양 수포가 생겨 병원에서 검사 후 ‘대상포진’ 진단을 받았다. 젊은 층을 포함해 모든 연령에서 발생할 수 있는 ‘대상포진’에 대해 순천향대 부천병원 감염내과 박성희 교수와 알아본다.대상포진은 수두-대상포진 바이러스(Varicella-Zoster Virus)가 신경절 내 잠복해있다가 면역력이 떨어져 재활성화되어 신경통과 피부 병변이 나타나는 질환이다. 50대 이상의 중년이나 고령층에서 많이 발생하나, 면역기능이 떨어진 환자나 과로·스트레스 등으로 면역력이 약해진 20, 30대 젊은 층에서도 발생할 수 있다.박성희 교수는 “대상포진은 고령에서 발생한다고 알려졌지만, 면역력이 떨어지면 누구에게나 발생할 수 있다. 대상포진이 발생하면 피부 발진과 함께 심한 통증이 동반되며, 일부 환자에서는 발진이 호전된 후에도 통증이 지속되면서 삶의 질이 저하될 수 있으므로 예방하는 것이 가장 좋다”고 말했다.주요 증상은 국소적인 부위의 발진·물집 그리고 해당 부위 통증으로, 몸통, 얼굴, 팔, 다리 등 전신 어디든 나타날 수 있다. 피부 병변은 신경절을 따라 붉은색 발진과 여러 개의 수포가 띠 형태로 군집해 나타난다. 피부 병변 없이 통증만 나타나기도 한다. 통증은 주로 타는 듯하거나, 욱신거리고, 칼로 찌르는 느낌이 드는 경우가 많다. 그 외에도 발열, 두통, 몸살, 피로감 등이 나타날 수 있다. 대상포진이 안면부에 나타나 눈, 귀를 침범하면 시력과 청력 저하 등 관련 합병증과 안면마비도 발생할 수 있다. 대상포진 통증은 피부 병변이 모두 사라진 후에도 수개월 이상 지속될 수 있는데, 이것을 ‘대상포진 후 신경통’이라고 한다.대상포진은 특징적인 피부 병변의 양상으로 대부분 진단할 수 있다. 전형적인 형태가 아니면 피부 병변에서 검체를 채취해 중합효소연쇄반응(PCR)을 통한 바이러스 핵산 검출, 현미경 검사, 바이러스 배양 등 추가적인 검사를 시행할 수 있다.대상포진은 발병 후 72시간 이내 치료를 시작해야 합병증 발생의 가능성이 줄어든다. 치료는 주로 항바이러스제를 통한 약물치료로 진행한다. 항바이러스제는 바이러스 전파를 감소시키고 피부 병변의 치료를 촉진하며 통증의 정도와 지속 기간을 감소시킨다.대상포진 예방을 위해서는 백신을 접종하는 것이 좋다. 60세 이상 성인에서 백신 1회 접종을 권장하며, 대상포진의 과거력 유무와 관계없으나 대상포진을 앓았더라도 재발 우려가 있으므로 회복 후 6~12개월이 지난 후 접종하면 재발 위험을 낮추고, 재발 시에도 통증을 줄일 수 있다. 면역 저하자나 임산부는 접종이 제한되어 있으므로, 접종 시 의사와 상의 후에 접종해야 한다.박성희 교수는 “대상포진은 지속되는 심한 통증으로 인해 삶의 질이 심각하게 저하될 수 있으므로 초기에 잘 치료하는 것이 중요하다. 또, 암 환자, 항암치료 환자, 장기이식 환자, 당뇨 환자, 에이즈 환자, 면역억제제 복용 환자, 고령 등 면역기능이 떨어진 사람은 일반인보다 대상포진에 취약하므로 주의해야 한다”고 말했다.
- 루닛, ‘루닛 스코프’ 임상적 가치 확인...美 학회서 발표
- 루닛 AI 바이오마커 플랫폼 ‘루닛 스코프 IO’.(사진=루닛)[이데일리 송영두 기자] 의료 인공지능(AI) 기업 루닛이 국제 학회에서 AI 바이오마커 플랫폼 ‘루닛 스코프 IO’에 대한 단독 및 공동 연구초록 3편을 발표한다고 8일 밝혔다.루닛은 8일부터 12일까지 미국 보스턴에서 개최되는 ‘2022년 면역항암학회(SITC 2022)에 참가한다. ’루닛 스코프 IO‘ 연구 논문 3편 중 1편은 구연 발표로 채택됐으며, 연구 내용은 행사 내 전시 부스에서 시연될 예정이다.루닛(328130)은 지난 2021년 국내 의료AI 기업으로는 최초이자 유일하게 SITC에 참석한 바 있다. 올해 SITC에서는 루닛 스코프 IO의 임상적 가치와 다양한 환경에서의 활용성을 뒷받침하는 연구 결과를 발표한다.첫번째 연구에서는 인체 내 세포 단백질인 HER2(인간 표피 성장 인자 수용체) 발현도와 환자 면역반응 사이의 관계를 평가했다. 연구진이 다양한 암종을 대상으로 루닛 스코프 IO를 활용해 면역세포인 종양침윤림프구(TIL)의 분포 정도를 분석한 결과, HER2 양성도와 TIL 분포는 암종별로 상이한 패턴이 나타남을 확인했다.이는 루닛 스코프 IO가 HER2 발현도를 정량적으로 측정하고, 환자의 면역반응을 예측하는 효과적 수단이 될 수 있음을 나타낸 결과다. 이번 연구에는 총 22개 암종 환자 7,322명의 TCGA(The Cancer Genome Atlas, 미국 국립보건원의 공개 빅데이터) 데이터가 사용됐다.두번째 연구에서는 비소세포폐암과 다른 암종의 주요 임상시험들에서 면역항암제 단독요법과 면역-화학항암제 병용요법의 치료 관련 이상반응(TRAE)으로 인한 치료 중단율을 비교했다.그 결과, 비소세포폐암에서 면역항암제 단독요법은 8.13%, 면역-화학항암제 병용요법은 17.54%의 치료중단율을 기록했다. 다른 암종에서는 면역항암제 단독요법이 9.32%, 면역-화학항암제 병용요법이 21.78%의 중단율을 나타내 면역항암제 단독요법이 면역-화학항암제 병용요법에 비해 현저히 낮은 중단율을 보였다.이는 루닛 스코프가 면역항암제의 효과 예측 바이오마커라는 점에서 치료 중단율이 낮은 면역항암제 단독요법 처방 환자들에게 유의미할 수 있음을 보여준 결과다. 이번 연구에는 41건의 면역항암 임상시험에 참여한 환자 1만3000여 명의 데이터가 활용됐다.루닛이 공동 참여한 연구에서는 MSS 대장암(현미부수체 안정형 대장암) 및 췌장암 환자를 대상으로 네오이뮨텍의 T세포 증폭제 NT-I7(물질명 efineptakin alfa)과 펨브롤리주맙(Pembrolizumab)의 임상적 효능 평가를 공개한다. 연구진이 루닛 스코프 IO를 통해 생검 샘플을 분석한 결과, NT-I7과 펨브롤리주맙의 병용이 종양 내 T세포 침투를 증가시킨 것으로 확인됐다.서범석 루닛 대표는 “지난해에 이어 올해 SITC에서도 루닛 AI 바이오마커 플랫폼이 다양한 임상현장에서 가치있게 활용될 수 있음을 입증할 수 있어 기쁘게 생각한다”며 “루닛은 앞으로도 다양한 암종에서 각 환자별 맞춤형 치료가 이뤄질 수 있도록 활발한 연구를 지속할 것”이라고 말했다.
- 비엘, BLS-H01 면역항암제 효능개선 연구성과 스페인에서 발표
- [이데일리 김지완 기자] 신약개발 전문 기업 비엘(142760)은 스페인 바르셀로나에서 진행된 ‘2022 EORTC-NCI-AACR’ 심포지움에서 ‘BLS-H01’의 면역항암제 효능개선 연구성과를 발표했다고 7일 밝혔다. 이도영 비엘 기술연구개발소장(상무)가 스페인 바르셀로나에서 진행된 심포지엄에서 BLS-H01 면역항암제 효능개선 연구성과를 발표했다. (제공=비엘)‘EORTC-NCI-AACR 심포지엄’은 항암 연구의 최신 지견 및 주요 제약사의 임상 성과가 발표되는 국제 학회로 유럽암학회, 미국 암연구소, 미국 암학회가 공동 주관해 유럽과 미국에서 매년 개최된다.비엘의 ‘BLS-H01(폴리감마글루탐산, γ-PGA)’는 소장 내 면역수용체에 작용해 NK세포, 수지상세포, T세포는 물론 인터페론의 분비를 촉진시켜 암에 대한 면역반응을 강화시키는 약리기전을 가지고 있다. 이번 심포지움에서는 대장암, 흑색종 등의 항암동물모델에서 PD-1 면역항암제와의 병용투여를 통해 ‘BLS-H01’에 의한 면역세포 활성화와 이에 따른 항암 시너지효과를 확보한 결과를 발표했다. PD-1 면역항암제는 금년 상반기에만 13조원의 매출을 올린 머크의 ‘키트루다(성분 : 펨브롤리주맙)’가 대표 약물이다. 글로벌 의약품 시장조사 기관인 ‘이밸류에이트파마(EvaluePharma)’는 2024년 PD-1 면역항암제의 시장규모를 546억달러(약 77조5000억원)으로 예측할 정도로 뛰어난 항암효과를 기반으로 고성장을 이어가고 있다. 하지만 PD-1 면역항암제는 효과를 보이는 반응환자 비율이 낮아 제한적인 환자들에게만 사용되는 한계가 있다. 최근에는 이 같은 한계를 극복하기 위해 반응률을 높이기 위한 목적으로 시너지 효과가 기대되는 다양한 약물들과의 병용투여 임상시험이 광범위하게 진행되고 있다.‘BLS-H01’의 핵심 성분인 감마PGA(γ-PGA)는 식물 유래 성분으로 면역조절 수용체인 TLR4에 작용해 면역세포를 활성화한다. 이를 통해 암세포, 감염세포 등 정상이 아닌 세포를 신속히 제거하는 기전을 가지고 있다. TLR4는 바이러스, 세균 등 외부침입 물질에 대한 면역반응의 필수 요소이나, 염증반응의 주요인자로 양면적 특성을 가지고 있다.비엘에서는 다년간의 연구를 통해 ‘BLS-H01’이 TLR4에 작용해 면역반응의 활성화를 유도하지만 염증 인자에는 작용하지 않는 특이적 약리기전을 규명했다. 회사측은 이를 토대로 암세포를 인식, 공격하는 면역세포 및 인터페론의 활성도를 증가시키면서도, 암세포가 좋아하는 염증성 환경을 차단하는 신개념 항암치료제로 개발을 진행중에 있다. 또한 이러한 약리기전은 암 뿐만 아니라 바이러스, 세균에 의한 세포 감염에도 적용할 수 있어 적응증을 확장해 나가고 있다. 비엘은 현재 ‘BLS-H01’로 SARS-CoV-2 바이러스 감염에 의해 폐렴이 수반되는 중등증 환자를 대상으로 코로나19 치료제 2상 임상시험을 진행하고 있다.비엘 관계자는 “BLS-H01은 면역세포 활성화와 염증을 수반하는 종양미세환경을 동시에 조절해 자체적인 항암효능은 물론, 면역항암제의 효능을 배가시켜주는 장점을 가지고 있다”며 “많은 제약사들이 TLR4를 표적으로 한 약물 개발을 시도했으나, 염증반응 등의 부작용으로 인해 성공하지 못했다. BLS-H01은 이 같은 한계를 극복할 수 있는 약물로 기대가 높다”고 밝혔다. 이어 “연구성과를 토대로 면역항암제 단독으로는 어려운 난치성 고형암에 대한 임상 진입이 조만간 현실화될 것으로 기대하고 있다”고 덧붙였다.