|
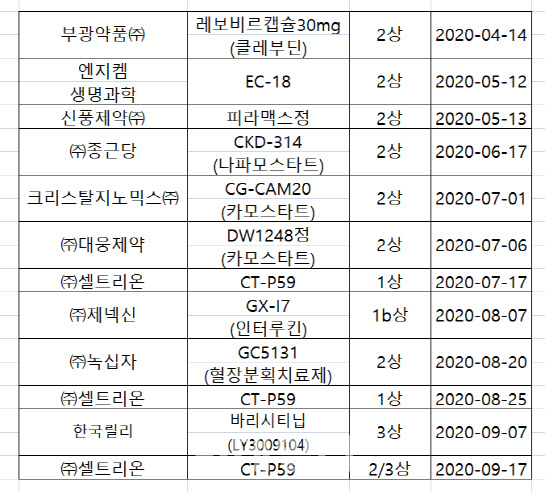
28일 제약 바이오업계에 따르면, 코로나 19 치료제 ‘GX-I7’을 개발중인 제넥신(095700)은 국내에서 임상 시험 개시 여부를 두고 고심 중이다. 제넥신은 8월 7일 1상 후기 단계에 해당하는 임상1b상 임상시험계획을 식품의약품안전처에서 승인받았지만 아직 모집된 임상 환자가 하나도 없다.
회사 관계자는 “국내 임상을 진행할지 안 할지 미정”이라며 “미국에서 관계사인 네오이뮨텍이 같은 물질로 FDA에서 임상승인을 받고 조만간 환자 투약을 앞두고 있는 데다 국내 환자 모집도 여의치 않아 동시다발적으로 임상을 해야 하는지 고심 중”이라고 말했다. 앞서 제넥신은 네오미뮨텍이 GX-I7의 코로나19 치료 임상시험계획을 미 FDA에서 승인받았다고 지난 6월에 밝혔다.
국내 코로나19 환자 모집이 여의치 않게 되자 임상 종료 시점을 불가피하게 뒤로 미루는 회사들도 속출하고 있다. 지난 4월 14일 코로나19 치료제 임상2상 시험계획을 가장 먼저 승인받은 부광약품(003000)은 애초 다음달까지였던 임상 마무리 시점을 내년 1월로 변경했다. 다음달에 임상을 마무리해야 하는 상황이지만 60명의 환자 모집을 아직 끝내지 못했기 때문이다.
부광약품 관계자는 “지난 18일에 임상시험 기간을 변경해 식약처에서 승인받았다”며 “내년 1월 이전에라도 환자모집을 끝내면 조기 종료할 수 있다. 국내에서는 임상 진행이 가장 빠른 상황”이라고 말했다.
크리스탈지노믹스 관계자는 “임상은 통상 임상 시설과 인력이 갖춰진 종합병원에서 해야 하지만 감염병 특성상 환자 이동에 제한이 많아 대형병원을 찾을 수 없는 상황”이라며 “환자 모집에 어려움을 겪는 것은 코로나19 치료제를 개발하고 있는 회사들의 공통된 문제”라고 말했다.
코로나19 환자는 주로 체육관 등을 개조한 생활치료센터나 감염병 전담병원으로 지정된 공공병원에 있다. 하지만 이런 곳은 임상을 할 수 있는 시설이나 인력이 충분한 곳이 아니다. 코로나19 환자 자체도 해외와 비교하면 많지 않다.
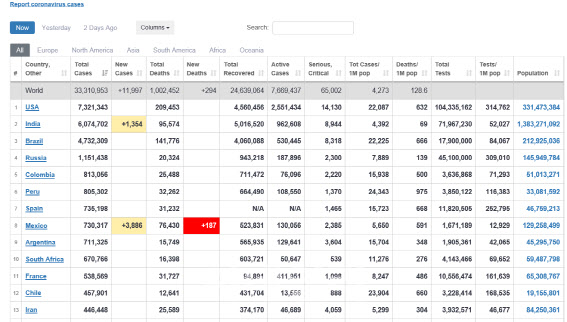
실제 국내 코로나 확진자는 28일 0시 기준 2만3661명이다. 이는 글로벌 통계웹 월드오미터에 따르면 그리니치 평균시(GMT) 28일 오전 6시22분 현재 전세계 79위다. 총 확진자 732만명이 넘는 세계 1위 미국이나 인도(607만명), 브라질(473만명), 러시아(115만명)에 견줘 매우 적다.
지난 6월17일 임상 2상시험을 승인받은 종근당 역시 식약처가 관리하는 의약품안전나라에 올라오는 임상정보상 최초 시험대상자 선정일이 공란으로 나온다. 식약처에 따르면 제약회사는 첫번째 환자 모집을 하고 20일이내에 이 상황을 의약품안전나라에 입력해야 한다. 종근당 관계자는 다만 “환자 모집 여부는 확인해줄 수 없다”고 말했다.
제약회사들은 코로나19 환자 모집에 유리한 해외로 눈길을 돌리고 있다. 종근당은 지난달 31일 러시아 식약처에서 코로나19 치료제 개발을 위한 임상 2상을 승인받았다. 엔지켐생명과학(183490)은 미 FDA에서 지난 8월 코로나 치료제 개발을 위한 임상 2상을 승인받았다.
일양약품은 러시아에서 코로나19 치료제 임상 3상을 진행중이다. 크리스탈지노믹스는 약물재창출로 진행하는 국내 임상과 달리 신약 후보물질로 코로나19 치료제를 개발하기 위한 미국 임상 2상을 허가받기 위해 준비 중이다. 셀트리온도 국내 환자 100명을 포함해 총 1020명을 대상으로 글로벌 임상 2·3상을 진행중이다. 대웅제약(필리핀, 인도, 멕시코)과 신풍제약(남아공)도 해외 임상을 하고 있다.
|









![[포토]축사하는 이상원 양형위원장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112200974t.jpg)
![[포토] 농가희망봉사단, 마을회관 기증품 전달](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112200740t.jpg)
![[포토]축사하는 한덕수 국무총리](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112200598t.jpg)
![[포토]오언석 구청장 '경원선 지하화 추진협의회' 출범식 참석](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112101263t.jpg)
![[포토]지드래곤, 출국](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112101253t.jpg)
![[포토]이력서 작성하는 어르신들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112101012t.jpg)
![[포토] 전국시도교육감 총회장에서 시위하는 조합원들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112101008t.jpg)
![[포토]이재명 더불어민주당 대표, 소상공인들과 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112100813t.jpg)
![[포토]]인사 나누는 이재명 더불어민주당 대표-김동연 경기지사](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112100709t.jpg)




![한일 격차 이 정도였어?…10분의 1 수준 토큰증권 시장의 숙제는[마켓인]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112201113h.jpg)