|
9일 코오롱생명과학에 따르면, 미국 FDA는 이르면 오는 11일(미국시간) 유전자치료제 ‘인보사케이주’(인보사)의 임상 3상 재개 여부에 대한 입장을 자회사 코오롱티슈진에 통보할 것으로 예상된다. 이는 통상 서류 접수 후 30일의 검토 기간을 거치는 FDA 규정에 따른 코오롱생명과학의 예측이다. 앞서 코오롱티슈진은 지난달 11일(미국시간) 임상 재개를 위해 FDA에서 요구했던 두번째 추가자료를 제출했다.
|
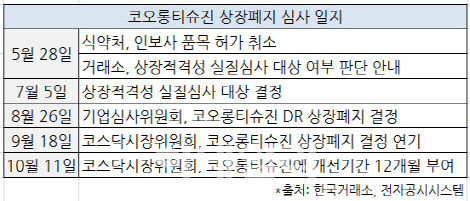
코오롱생명과학은 국내에서 관련 이슈로 식품의약품안전처에서 인보사케이주의 품목허가 취소를 당하는 등 코너에 몰렸고 그해 8월에 1차로 FDA에 자료를 제출해 임상 재개를 노렸다. 하지만 FDA는 한달 뒤에도 임상 중단을 해제하지 않으면서 2차로 추가 자료 제출을 요구했다.
FDA는 2차 보완자료 요구에서 임상 시험용 의약품의 구성성분에 대한 추가 특성 자료를 요구했다. 코오롱생명과학 관계자는 “암을 유발할 수 있다고 하는 신장세포의 특성에 관한 추가 자료”라며 “안정성 측면의 보완 자료로 이해하면 된다”고 말했다.
코오롱생명과학은 FDA 임상 재개가 결정되면 국내 품목허가 취소와 각종 소송에 직면한 상황에서 기사회생할 기회를 잡게 된다. 반면 이번에도 임상 중단 상태가 그대로 유지(Continue Clinical hold)된다면 경영상 위기가 가중될 수 있다는 분석이다.
코오롱생명과학은 인보사에 대한 제품 수출 및 관련 기술수출건으로 총 1조2000억원 규모의 수출 계약을 체결한 상태다. 다국적 제약사 먼디파마 등 수출 상대방은 FDA 임상 재개 가능성을 고려해 아직 계약금 반환 요구 등에 나서지 않는 것으로 알려졌다.
|
임상 컨설팅 업계의 한 대표는 “FDA가 추가 자료 보완을 요구할 수 있겠지만 ‘임상 계속 중단’을 넘어서는 다른 조치는 현실적으로 나오기 어렵다”며 “FDA 규정상으로도 중단된 임상을 강제 종료할 수 있게 하는 방법이 없는 것으로 알고 있다”고 언급했다.
다만 바이오벤처의 한 대표는 “FDA가 강제로 취소하지 않더라도 지적 사항을 회사가 해소할 수 없다면 결국 회사가 스스로 임상을 철회할 수밖에 없다”며 “임상 중단은 제약회사 입장에서는 준비를 엉성하게 했다는 의미로 흔한 경우는 아니다”고 설명했다.
코오롱생명과학 관계자는 “임상 중단이 계속되더라도 인보사가 실패하는 게 아니고 수출계약 등에서도 문제가 안 될 수 있다”며 “추가 보완자료 요구 등 관련 공문 내용이 확인되기 전까지는 이후 상황을 예측하기 어렵다”고 강조했다.









![[포토]골프존 파스텔 합창단,지역주민위한 공연](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400127t.jpg)
![[포토]'규탄사하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401162t.jpg)
![[포토]비상계엄 해제 후 한자리에 모인 한덕수 총리와 국무위원들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401092t.jpg)
![[포토]최상목 경제부총리, '어두운 표정'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400960t.jpg)
![[포토]청사들어서는 한덕수 총리](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400786t.jpg)
![[포토] 대통령실 입구의 취재진](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400817t.jpg)
![[포토]'긴급 의원총회 참석하는 추경호 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400571t.jpg)
![[포토]'긴박했던 흔적들'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400485t.jpg)
![[포토]조국, '국가 비상사태 만든 이는 尹...탄핵해야'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400366t.jpg)
![[포토]尹, '비상 계엄 해제할 것'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400277t.jpg)




