|
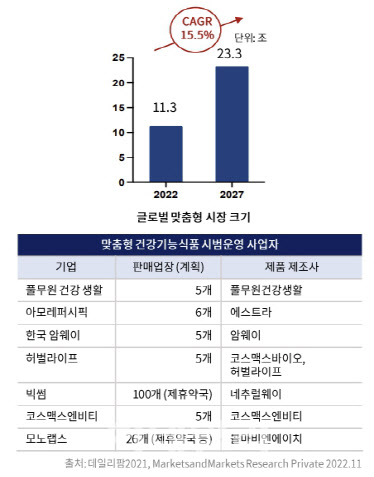
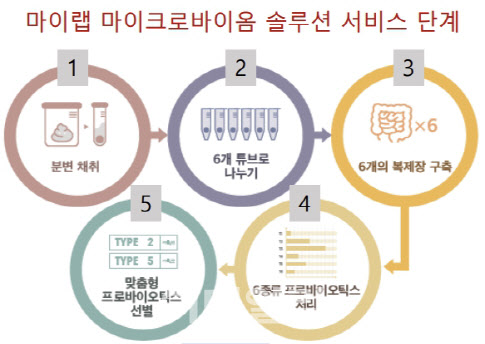
에이치이엠파마는 자체 개발해 다수 특허를 보유한 플랫폼 ‘PMAS’으로 맞춤형 헬스케어 시장 공략을 확대하고 있다. PMAS는 대변에서 사람의 장 환경을 복제해 각각의 장 환경에 맞는 최적의 솔루션을 찾아내는 기술이다. 에이치이엠파마는 지난해 8월부터 시작한 맞춤형 헬스케어 사업 ‘마이랩’을 통해 지난해 매출 32억원을 냈다. 마이랩은 출시된 지 1년이 채 되지 않았지만 벌써 2만 건이 넘는 고객 데이터베이스를 구축했다. 현재 분변 분석키트만 3만5000개 가량 팔렸고 프로바이오틱스 제품 구매 성장률도 140%에 달한다고 밝혔다. 나아가 에이치이엠파마는 6개월 단위로 전후 모니터링 서비스도 제공한다. 이를 통해 주기적으로 데이터를 대량 수집할 수 있다는 설명이다.
지요셉 에이치이엠파마 대표는 “많은 데이터베이스 확보가 헬스케어 사업의 핵심이다. 헬스케어는 두려움을 먹고 사는 사업인데 이걸 통제하는 것은 데이터베이스다. 이를 통해 건강을 예측해야 헬스케어 시장을 장악할 수 있다”며 “문제는 데이터 한 건 당 500달러에 달할 만큼 비싸단 건데, 우리는 암웨이와 손잡고 돈을 벌면서 데이터베이스를 구축하고 있는 셈”이라고 말했다.
|
PMAS로 신약 개발 속도
에이치이엠파마는 PMAS를 통해 신약 개발에도 속도를 내고 있다. 대표적인 파이프라인은 우울증 치료제다. 장내 미생물을 매개로 장신경계와 중추신경계가 연결돼 상호작용한다는 ‘장뇌축’(Gut-brain axis) 이론에 기반해 개발을 진행 중이다.
에이치이엠파마의 우울증 치료물질 ‘HEMP-001’은 지난달 미국 식품의약국(FDA)으로부터 2상 임상시험계획서(IND) 승인을 받았다. 회사는 임상시험이 예정대로 진행된다면 4년 뒤쯤 품목허가신청(BLA)을 할 수 있을 것으로 전망하고 있다. 나아가 불안증 등 다른 뇌질환으로도 적응증을 확장해 나갈 계획이다.
또 다른 파이프라인인 저위전방절제증후군(LARS) 치료제 후보물질은 지난 3월 호주 식품의약품안전청(TGA)으로부터 임상 2상 IND 승인을 받았다. LARS는 항문 괄약근을 보존하는 수술을 받은 환자에게 생기는 기능적인 장애를 말한다. 보건복지부에서 발표한 국가암등록통계에 따르면 대장암 환자의 5년 상대생존율은 90%이상으로 보고된 바 있으나, 관련 수술을 받은 환자 중 약 80%가 후유증으로 배변 조절 분능 현상 등을 동반하는 LARS를 겪고 있다. 에이치이엠파마는 호주 임상을 거칠 경우 미국 FDA와 유럽의약품청(EMA)에서도 바로 승인 신청할 수 있어, 미국과 유럽으로의 진출이 용이할 것으로 내다보고 있다.







![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)
![[포토]2025학년도 정시 대학입학정보박람회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900743t.jpg)
![[포토]북적이는 정시 대학입학정보박람회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900708t.jpg)
![[포토] 미소짓는 오세훈 서울시장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900574t.jpg)

![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)


![‘12·3 비상계엄’ 그날밤…국민의힘·민주당 단체방은 왜 이렇게 달랐나[국회기자24시]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122200032h.jpg)