|
양 측은 23일 서울행정법원 행정12부(재판장 홍순욱) 심리로 열린 집행정지 심문에서 4시간 여 동안 공방을 주고받았다.
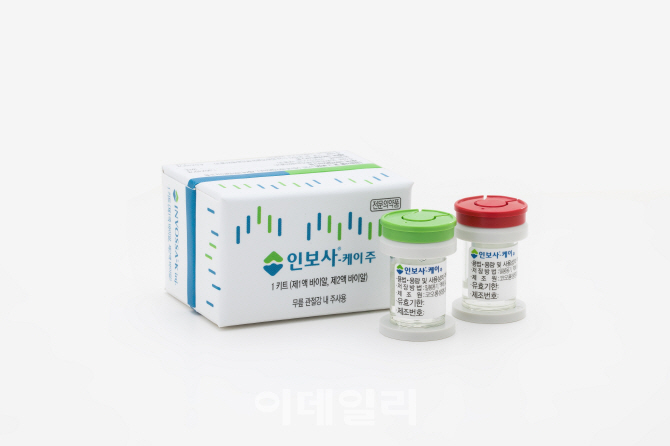
인보사는 사람의 연골세포가 든 1액과 연골세포의 성장인자(TGF-β1)를 잘 만들도록 형질전환한 세포가 든 2액으로 구성된 세계 최초 퇴행성관절염 유전자치료제로 2017년 식약처 허가를 받았다.
당초 이 2액은 형질전환한 연골세포가 주성분으로 알려졌지만 지난 4월 형질전환 신장세포로 밝혀지면서 식약처가 품목허가 이달 초 품목허가를 취소했고, 코오롱 측은 즉각 행정소송과 처분 효력 집행정지를 신청했다.
이에 대해 식약처 측은 “안전성과 유효성의 문제가 아니라 ‘주성분’이 없는 것 자체가 문제”라며 “형질전환 연골세포를 이용해 약을 만든다고 허가를 받았는데 그 세포 자체가 없었다는 게 밝혀져 허가취소 결정을 한 것”이라고 반박했다.
코오롱 측 변호사는 “자발적 판매 중지와 유통 중단 상황으로 시장에서 더 이상 처방이 불가능한 상황”이라며 “여기에 더해 허가취소까지 확정되면 곧 시작할 장기추적조사도 영향을 받을 수 있다”며 허가취소를 중지해 줄 것을 요청했다. 이에 대해 식약처는 “보관 중인 원료의약품도 폐기해야 한다”며 “관리 소홀로 인보사가 외부로 불법 유통될 가능성이 있다”고 주장했다.
법원은 양측의 주장이 대립하고 보완할 자료가 있는 만큼 당초 예정됐던 최종 결정 기일을 29일에서 다음달 12일이나 13일로 연기했다. 이에 따라 잠정 효력정지도 내달 13일까지로 연기됐다.








![[포토]은행권 소상공인 금융지원 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300609t.jpg)
![[포토]인사청문회 출석한 마은혁 헌법재판관 후보자](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300404t.jpg)
![[포토]아침 영하 10도, 꽁꽁 얼어붙은 도심](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300843t.jpg)
![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)


![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)


