|
19일 금융위원회는 제약·바이오 연구비 회계처리와 관련해 △신약은 임상3상 △바이오시밀러(바이오의약품 복제약)는 임상1상 △제네릭(화학의약품 복제약)은 생동성(생물학적 동등성) △진단시약은 제품 검증 단계부터 자산화가 가능하도록 한 기준을 발표했다. 이에 대해 제약·바이오 업계에서는 신약개발과 관련, 재무적인 불확실성을 해소하면서 업계가 한단계 더 도약할 수 있는 계기가 될 것으로 내다봤다. 제약사 고위관계자는 “제약·바이오 업체들이 그동안 회계기준을 자의적으로 적용하다 보니 객관적이지 않고, 심지어 회사 가치를 부풀린다는 의혹도 있었다”며 “이번 발표는 이러한 불확실성을 제거, 제약·바이오 업계 신뢰성을 높이고 재무적으로 투명화 할 수 있는 계기가 될 것”이라고 말했다.
셀트리온(068270)과 삼성바이오에피스 등 바이오시밀러에 집중해온 업체들도 이번 발표를 반기는 분위기다. 특히 셀트리온은 올해 초 연구비 회계처리와 관련해 큰 홍역을 치렀다. 도이치방크가 ‘연구비의 27%만 비용으로 처리해 영업이익률을 부풀렸다’는 보고서를 발표한 것. 이 때문에 셀트리온 주가가 하루새 10% 가까이 떨어지는 등 어려움을 겪었다. 당시 셀트리온 측은 “성공 가능성이 희박한 신약과 달리 바이오시밀러는 개발기간과 비용이 모두 신약보다 덜 들고 성공률도 높다”며 반박하기도 했다. 한 바이오시밀러업체 관계자는 “이번 금융위 발표를 통해 임상1상부터 연구비를 자산화할 경우 투자금 회수가 빨라질 것”이라며 “이는 또 다른 프로젝트 추진을 수월하게 하는 등 선순환구조로 이어질 수 있다”고 말했다.
미국 식품의약국(FDA)에 따르면 신약개발 성공률은 9.6%에 불과하다. 임상1상은 성공률이 63.2%에 이르지만 이후 임상2상에 들어가면 성공률은 30.7%로 낮아진다. 임상1상은 건강한 사람을 대상으로 안전성을 규명하기 때문에 비교적 성공률이 높다. 반면 제한된 환자를 대상으로 효과와 부작용을 검증하는 임상2상에 들어가면 성공률은 절반으로 줄어드는 것. 임상3상은 환자 수를 대폭 늘려 진행해야 한다. 그래서 임상3상에는 많은 비용이 들어가며 기간도 길다. 금융위가 임상3상부터 연구비 자산화를 인정한 것도 이런 특성을 고려한 것으로 보여진다.
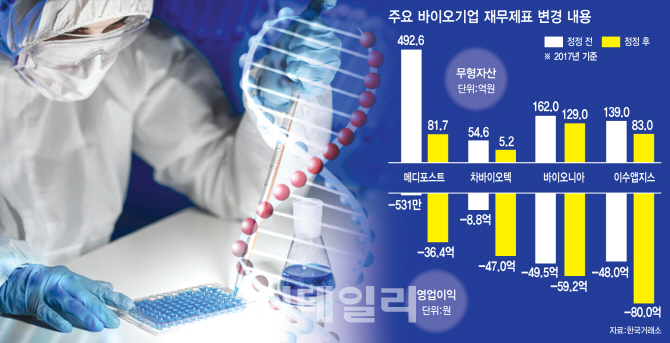
통상 글로벌 제약사들은 연구비와 관련, 전임상과 임상1·2·3상을 마친 후 승인을 받아야만 자산으로 처리한다. 반면 국내 일부 바이오기업들은 전임상 등 초기단계부터 비용이 아닌 자산으로 처리해왔다. 금감원에 따르면 2016년 기준으로 총 152개 제약·바이오 상장사 중 55%에 해당하는 83곳이 연구비를 자산으로 처리했다. 이럴 경우 영업이익이 올라가는 효과를 볼 수 있다.
반면 이번 발표에 불만의 목소리도 있다. 또 다른 업계 고위관계자는 “하나의 획일적 잣대를 들이대기에는 각 업체별 상황이나 전략적인 목표가 너무 다양하다”며 “특히 창업 초기에 있는 바이오벤처의 경우 현실에 맞게 유연하게 기준을 적용하지 않을 경우 투자금 조달에 어려움을 겪게 될 것”이라고 덧붙였다.








![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)

![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)