|
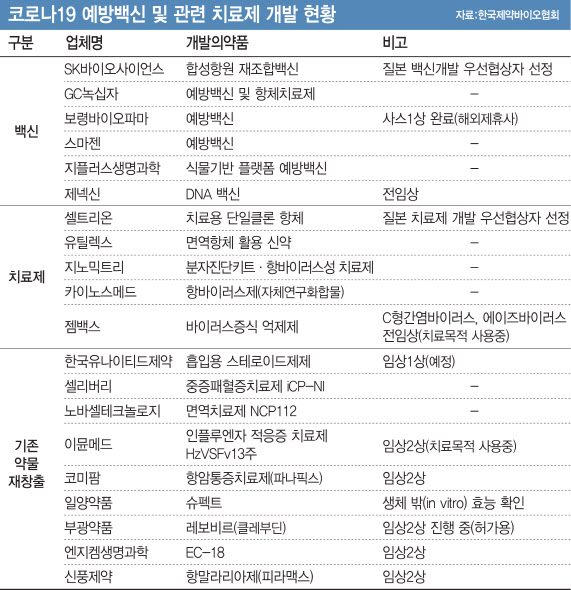
13일 제약·바이오업계에 따르면 ‘악템라’는 쥬가이제약이 개발해 2005년 일본의 첫 항체 의약품으로 등장했다. 2008년에는 류머티스성 관절염 치료제로 판매되면서 쥬가이 주력 제품이 됐다. 그동안 류머티즘 등 8개 효능에 관한 승인을 취득했다.
주가이제약의 모기업인 스위스 다국적 제약사 ‘로슈(Roche)’는 악템라에 코로나19 적응증을 추가하는 글로벌 임상 3상에 돌입한 상태다. 빠르면 이달 안에 임상이 완료될 것이란 전망이 나온다. 신약 재창출이란 이미 시판·사용되고 있어 안전성이 입증된 약물이나 임상 시험에서 안전성은 있지만 효능이 충분히 입증되지 않아 허가 받지 못한 약물을 대상으로 새로운 적응증을 규명해 코로나19 신약으로 개발하는 방법이다.
이날 식품의약품안전처는 신풍제약에 대해 경증 또는 중등증 코로나19 환자 대상 항말라리아제인 ‘피라맥스’정 유효성 및 안전성을 비교하기 위한 임상 2상을 승인했다. 지난 12일 엔지켐생명과학이 코로나19로 인한 폐렴 환자에 ‘EC-18’의 임상 2상을 허락받은 지 단 하루 만에 새로운 임상 시험 계획(IND)이 통과한 것이다. 이들 2개 제약사에 한 달가량 앞서 부광약품은 지난달 14일부터 중증 환자에게서 ‘레보비르(클레부딘)’와 히드록시클로로퀸정의 안전성·유효성을 평가하는 판매 허가용 임상 2상을 진행 중이다.
|
이번 결과는 중국에서 20명의 환자와 나폴리 코투그노병원에서 치료받은 2명의 이탈리아 환자에서 얻은 긍정적 성과에 이은 가장 광범위한 임상이다. 올해 5~6월 임상이 마무리된 뒤 오는 7월께 자가면역 리뷰(Autoimmunity Reviews) 국제학술지에 실릴 예정이다.
다만 국내 판권만을 확보한 JW중외제약이 약물재창출을 위해서는 악템라 개발사인 주가이제약과 전 세계 임상 3상 시험을 주도하고 있는 로슈 등 원고객사와 협의·조율해야 할 부분이 남아있어 쉽게 결정할 문제는 아니라는 관측도 제기된다.








![[포토]긴급현안질의, '답변하는 박안수 육군참모총장'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120500534t.jpg)
![[포토]서울 지하철, '계엄 파문 속' 3년 연속 파업](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120500482t.jpg)
![[포토]최고위, '모두발언하는 박찬대 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120500479t.jpg)
![[포토]최고위, '모두발언하는 한동훈'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120500432t.jpg)
![[포토]골프존 파스텔 합창단,지역주민위한 공연](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400127t.jpg)
![[포토]국회 월담하는 우원식 국회의장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401332t.jpg)
![[포토]'규탄사하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401162t.jpg)
![[포토]비상계엄 해제 후 한자리에 모인 한덕수 총리와 국무위원들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401092t.jpg)
![[포토]최상목 경제부총리, '어두운 표정'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400960t.jpg)
![[포토]청사들어서는 한덕수 총리](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400786t.jpg)



![국민 10명 중 7명 尹 탄핵 찬성…부산·대구에서도 60% 이상[리얼미터]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120500353h.jpg)
