|
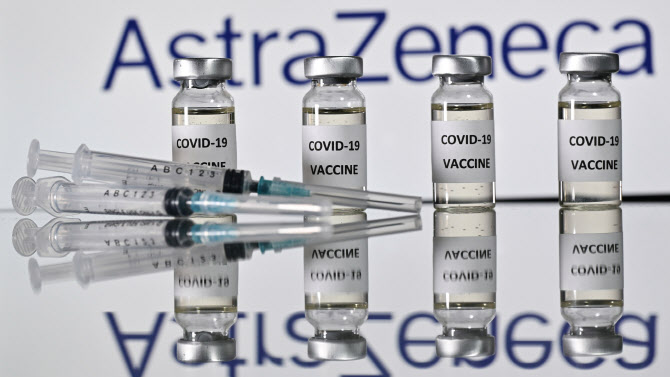
다만 영국 정부는 차일피일 미루던 자국산 AZ 백신에 대한 긴급사용을 승인 뒤늦게 승인했다. AZ 백신이 미국 식품의약처(FDA) 승인을 받지 못하더라도 EU의 유럽의약품청(EMA) 승인만 받으면 곧바로 도입해 내년 2월부터 국내 접종을 시작하겠다고 공언한 우리 방역당국으로선 영국발(發) 희소식에 그나마 한시름 놓을 수 있게 됐다.
29일(현지시간) 주요 외신에 따르면 EU 내 백신 승인처인 EMA의 노엘 와션 부청장은 이날 벨기에 현지신문과 인터뷰에서 “AZ 백신은 내년 1월 내 EMA의 사용 승인 권고를 받기 힘들 것”이라고 밝혔다. 그러면서 “현재 AZ는 EMA에 임상시험에 대한 데이터만 제출했다”며 “현 수준의 데이터로는 긴급사용 승인을 내주기엔 충분하지 않다. 추가 데이터가 필요하다”고도 강조했다. 와션 부청장은 AZ가 지난 23일 영국 당국에 백신의 출시신청 절차를 완료했다고 밝힌 데 대해서도 “우리는 전혀 모르는 상태”라면서 “영국 당국은 긴급 사용을 허가할 수도 있지만 우리는 그렇게 하지 않겠다. 제약사가 먼저 자사의 모든 백신이 고품질이라는 점을 증명해야 한다”고도 했다.
그러나 EU는 AZ 백신 확보가 쉽지 않을 것으로 판단해 화이자·바이오엔테크 백신 1억 회분을 추가로 주문했다.
우르줄라 폰데어라이엔 EU 집행위원장은 이날 트위터에 이같이 쓴 뒤, “이로써 우리는 안전하고 효과적으로 알려진 화이자·바이오엔테크 백신 3억도즈를 확보하게 됐다”고 했다.
이미 대량으로 AZ 백신 구매계약을 맺고 내년 2월부터 접종을 시작하려 했던 우리 방역당국으로선 희소식이다. 한국 방역당국은 AZ 백신 외에도 이미 각국의 승인이 난 모더나·얀센 백신은 내년 2분기부터, 화이자 백신의 경우 3분기부터 도입하기로 계약을 맺었다.






![[포토] 조사 마친 윤석열 대통령](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011501678t.jpg)
![[포토] 코스피, 코스닥 내림세...](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011501243t.jpg)
![[포토]'내란 우두머리 피의자' 윤석열 대통령 공수처로 이동](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011501058t.jpg)
![[포토] 네스프레소 2025 캠페인 론칭 토크쇼](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011501014t.jpg)
![[포토] '와일드무어' 미디어 행사](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011501005t.jpg)
![[포토]공수처 차고로 들어가는 윤 대통령 차량](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011500861t.jpg)
![[포토]사다리로 차벽 넘는 공수처](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011500701t.jpg)
![[포토]공개된 팰리세이드 풀체인지](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011500422t.jpg)
![[포토]공공기관 채용정보박람회 개최…“신규채용 2만4000명 추진”](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011400899t.jpg)
![[포토] 설 명절 자금 방출](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011400672t.jpg)

![[포토]박현경,백여 명의 팬들과 즐거운 출정식 개최](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2025/01/PS25011200149h.jpg)


