[이데일리 김진수 기자] HLB는 간암 신약 허가를 위한 미국 식품의약국(FDA)의 마지막 관문인 제조 및 품질관리(CMC) 실사가 완료됐다고 14일 밝혔다. 이 과정에서 FDA는 항서제약에 총 3가지 경미한 사항에 대해 지적받았다.
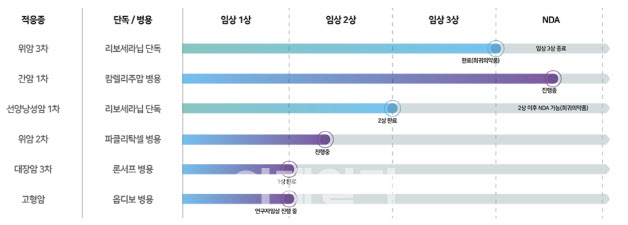 | | HLB 파이프라인. (사진=HLB 홈페이지) |
|
이번 CMC 실사는 파트너사인 중국 항서제약의 면역항암제 ‘캄렐리주맙’의 생산시설을 대상으로 이달 초 진행됐다. HLB의 항암제인 리보세라닙에 대한 실사는 이미 완료됐다.
CMC 실사는 FDA 심사관이 의약품의 생산시설을 방문해 전체 생산 시설과 공정을 직접 확인하는 절차로, 이번 실사는 지난 1차 허가 심사 때 통보받았던 보완사항을 포함해 모든 시설과 공정에 대해 원점부터 재점검하는 수준으로 진행됐다.
HLB는 항서제약이 총 3가지 경미한 사항에 대해 개선 요청을 받았으며, 충분히 해소 가능하다는 입장을 전달해왔다고 밝혔다. 해당 사항을 전달받은 HLB의 미국 자회사 엘레바도 요청받은 사안들이 신약허가에 영향을 끼칠만한 사항은 아니라는 판단이다.
특히 지난해 11월 완료된 BIMO(임상병원 모니터링) 실사에 이어 이번 CMC 실사도 예정보다 일찍 진행됐다는 점, 대대적으로 진행된 실사 결과 경미한 3가지 사항의 지적만 있었고, 항서와 엘레바가 모두 빠르게 개선이 가능하다고 의견을 모았다는 점을 들어 신약허가 기대감이 더욱 높아졌다는 입장이다.
HLB는 항서제약이 곧바로 3가지 사항에 대한 보완서류를 준비하고 있으며, FDA 규정에 따라 15일(영업일 기준) 내 FDA에 제출할 예정이라고 밝혔다. 이후 FDA는 개선사항을 반영해 신약허가 결정기일(PUDFA date)인 3월 20일 내 신약허가 여부를 결정할 것으로 전망된다.
한용해 HLB그룹 CTO는 “기존 허가되지 않은 2개 약물 간의 병용요법인만큼 FDA는 이번 CMC 실사에서도 원점에서 검토하는 수준으로 모든 사안을 면밀하게 검토한 것으로 보인다”며 “항서제약과 엘레바 모두 사소한 미비점이 없도록 신약 승인 결과가 나올 때까지 최선을 다할 것”이라고 말했다.







![[포토]공공기관 채용정보박람회 개최…“신규채용 2만4000명 추진”](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011400899t.jpg)
![[포토] 설 명절 자금 방출](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011400672t.jpg)
![[포토] 우체국쇼핑 "설 선물 특가로 구매하세요~"](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011400640t.jpg)
![[포토]윤석열 대통령 관저 출입하는 차량들](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011300878t.jpg)
![[포토]'발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011300770t.jpg)
![[포토] 이동활 한우자조금위원장, "올 설에 한우드세요~"](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011300684t.jpg)
![[포토]'유튜브 생중계 화면 바라보는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011300614t.jpg)
![[포토]국민의힘 비상대책위원회의](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011300576t.jpg)
![[포토] 추위 잊은 송어얼음낚시](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011200345t.jpg)
![[포토]윤석열 대통령 체포영장 2차 집행 초읽기](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011200302t.jpg)
![[포토]박현경,백여 명의 팬들과 즐거운 출정식 개최](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2025/01/PS25011200149h.jpg)



