식약처는 디지털 치료제를 ‘디지털 치료기기’로 이름을 붙이면서 지난 2020년 허가 심사 가이드라인을 발표했습니다. 디지털 치료제도 치료제이다 보니 임상을 해야합니다. 탐색 임상과 확증 임상 두 단계로 나뉘는데요, 현재 확증 임상 단계를 밟고 있는 치료제는 5곳입니다.
5개사 치료제가 식약처 임상 막바지
2022년 10월 기준으로 국내에서 식약처 디지털치료제 가이드라인에 맞춰 확증 임상 단계를 밟고 있는 곳은 △뉴냅스 △라이프시맨틱스 △에임메드 △웰트 △하이 등 5곳입니다. 이들 업체 가운데 1호 치료제 주인공이 나올 것으로 보입니다.
5개중 2개는 불면증 치료제입니다. 웰트는 지난해 9월 ‘필로우Rx’ 확증 임상시험 승인을 받아 진행중입니다. 수집한 환자의 데이터와 병원 데이터를 연동해 맞춤형 수면 일정을 제시합니다. 에임메드의 ‘솜즈’도 환자에게 수면 습관 교육과 자극 조절 등 환자의 행동을 중재하거나 제한하는 프로그램을 제공하고 있습니다. 웰트와 같은 시기에 확증 임상시험을 승인 받았습니다. 가장 빨리 식약처 임상 단계를 밟은 곳은 뉴냅스입니다. 뉴냅스는 뇌 손상 후 시야장애를 개선하는 ‘뉴냅비전’을 개발하고 있습니다. VR 기기를 착용한 환자에게
|
유일한 상장사인 라이프시맨틱스(347700)는 폐암·만성폐쇄성 폐질환(COPD) 환자가 집에서 호흡기 재활을 할 수 있는 ‘레드필 숨튼’을 개발하고 있습니다. 레드필 숨튼은 유산소 운동을 통해 증상을 완화하는 데 초점을 두고 있습니다.
김진우 하이 대표는 “전 세계적으로 범불안장애 환자가 증가하고 있다. 이에 따른 디지털 치료제 수요는 지속 증가할 것”이라며 “글로벌 시장을 선점할 수 있도록 연내 국내 임상을 끝내고 2023년에 미국 진출을 목표로 절차를 진행하겠다”고 말했습니다.
처방·보험 적용 기준 등도 발 맞춰야
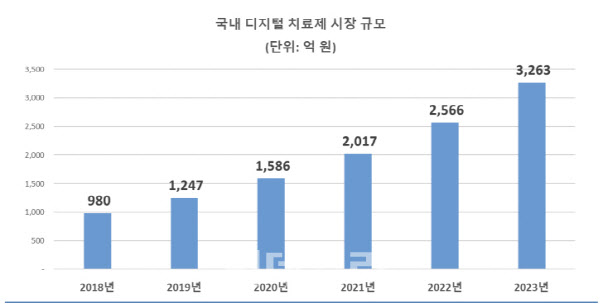
한국전자통신연구원이 추산한 국내 디지털 치료제 시장 규모는 2500억원 수준입니다. 식약처 승인을 받고, 처방까지 이뤄지게 된다면 이 규모는 훨씬 커질 수 있다는 전망이 나옵니다.
다만 아직까지 명확한 처방 기준이나 보험 적용 관련 기준이 뚜렷하게 정해진 바가 없습니다. 중요한 수가 문제도 남아있습니다. 건강보험 적용 여부에 따라 약값이 달라지기 때문입니다. 개발 업체들 입장에서는 불확실성이 해소되지 않은 상황인겁니다.
지난 4월 1일부터 미국에서는 전 세계에서 처음으로 디지털 치료제에 보험코드를 부여하기로 했습니다. 일반 의약품 처럼 의사 처방 후 약국에서 조제해 청구하는 시스템이 적용되는 겁니다. 올해 보험코드가 부여된 것은 앞서 소개해드린 페어 테라퓨틱스의 △약물 사용 장애(SUD) △오피오이드 사용 장애(OUD) △만성 불면증 치료제로 총 3개입니다.
전인용 KDB미래전략연구소 미래전략개발부 연구원은 최근 보고서에서 “세계 각국은 디지털 치료제 분야의 기술 혁신과 시장 확대를 위한 정책적 지원을추진 중”이라며 “우리나라도 이에 상응하는 지원 방안 수립이 필요한 상황”이라고 짚었습니다.
|









![[포토]은행권 소상공인 금융지원 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300609t.jpg)
![[포토]인사청문회 출석한 마은혁 헌법재판관 후보자](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300404t.jpg)
![[포토]아침 영하 10도, 꽁꽁 얼어붙은 도심](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300843t.jpg)
![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)


![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)


