|
허쥬마의 국내 판매를 맡고 있는 셀트리온제약(068760)은 올해 4월 허쥬마의 보험 약가를 취득해 시판에 돌입했으며 8월부터 일부 병원에서 허쥬마의 처방을 시작했다고 15일 밝혔다.
허쥬마는 2014년 1월 한국식품의약품안전처(MFDS)로부터 허가 받은 첫 허셉틴 바이오시밀러로 조기유방암과 전이성유방암 전이성위암 등의 치료에 처방된다.
허쥬마의 오리지널의약품인 허셉틴(로슈·Roche)은 세계적으로 연간 약 7조9000억원의 매출을 기록하는 블록버스터 의약품으로 국내 매출 규모는 연간 1000억원 상당으로 추산된다.
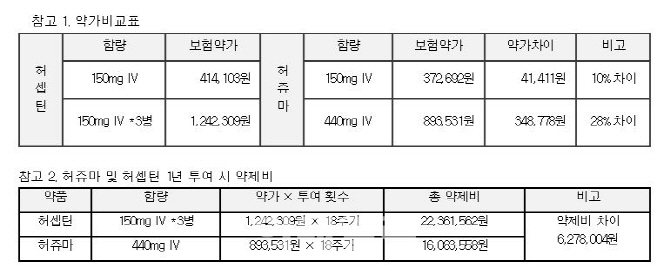
성인 조기유방암 환자(체중 60kg 기준)가 허쥬마 440㎎을 투여 받을 경우 경쟁 항체의약품 150㎎ 3병을 투여 받을 때와 비교해 연간 18주기 투여 시 약제비는 약 30%(627만8004원) 절감된다고 셀트리온 측은 설명했다. 특히 약제비를 전액 환자가 부담하는 비급여 영역의 초기 유방암 환자의 치료 비용 부담은 크게 줄 것으로 기대된다고 덧붙였다.
셀트리온 관계자는 “셀트리온은 지난 해 10월 유럽 EMA(유럽의약품청)에 허쥬마 허가를 신청했으며, 올해 7월 미국 FDA(미국 식품의약국)에도 허가를 신청하는 등 글로벌 론칭 일정을 계획대로 진행하고 있다”며 “전 세계 환자들이 바이오시밀러의 혜택을 볼 수 있도록 더 많은 국가에서 허쥬마 허가 획득 및 조기 출시를 위해 노력하겠다”고 말했다.
|








![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)
![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)

![40년간 아무도 예상치 못한 AI 붐에 대비한 '이 사람'[파워人스토리]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122300015h.jpg)
