|
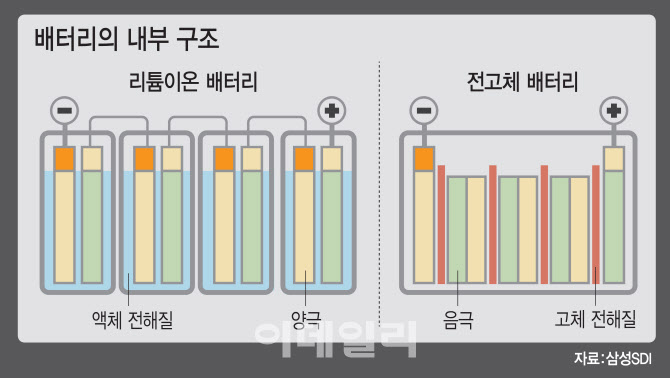
리튬이온 배터리는 리튬 이온이 양극과 음극 사이를 이동하는 화학적 반응을 통해 전기를 만들어내는 배터리입니다. 리튬이온 배터리는 크게 양극, 음극, 전해질, 분리막으로 구성됩니다.
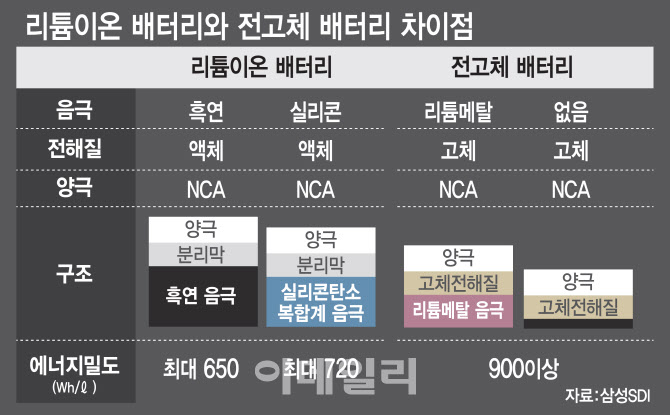
우선 양극재는 리튬 이온을 저장하고 방출하는 역할을 합니다. 리튬이온 배터리에는 다양한 양극 소재가 사용될 수 있는데 대표적인 소재로는 리튬·코발트 산화물(LiCoO2), 리튬·니켈·코발트·알루미늄 산화물(LiNiCoAlO2), 리튬·망간 산화물(LiMn2O4), 리튬·철·인산염(LiFePO4) 등이 있습니다. 음극재는 리튬 이온을 받아들이는 역할을 합니다. 음극 소재로는 흑연이 가장 많이 사용되며 최근에는 실리콘, 그래핀 등 새로운 소재도 연구되고 있습니다.
전해질은 리튬 이온의 이동을 돕는 역할을 하며, 분리막은 양극과 음극이 직접적인 접촉을 막아 단락(합선)을 방지하는 역할을 합니다. 전해질에는 리튬염을 넣은 액체 유기용매, 분리막은 일반적으로 폴리프로필렌(PP)이나 폴리에틸렌(PE)으로 만들어집니다.
여기서 우리가 살펴볼 것이 전해질입니다. 전해질은 리튬 이온의 ‘통로’ 역할을 합니다. 배터리 충전 중에는 양극에서 음극으로 리튬 이온들이 전달돼 화학 반응에 참여하고, 방전 중에는 반대로 음극에서 양극으로 리튬 이온들이 이동하면서 전기에너지를 생성합니다.
현재 우리가 흔히 사용하는 전해질은 액체 형태입니다. 액체 전해질의 가장 큰 장점은 높은 이온 전도성과 제조 비용이 상대적으로 저렴하다는 점을 꼽을 수 있습니다. 액체 전해질을 통해 이온들이 빠르게 이동할 수 있어서 빠른 충방전 속도와 높은 출력 전력을 제공할 수 있습니다. 하지만 액체 전해질은 급격한 온도 변화나 강한 내·외부 충격, 또는 과충전이나 과방전 등으로 화재나 폭발이 발생할 수 있다는 단점이 있습니다. 이는 배터리 용량을 늘리는데 한계점으로 지적됩니다. 또 온도가 낮아지면 액체로 이뤄진 전해질을 이동하는 리튬 이온의 이동 속도가 느려지면서 배터리 성능이 떨어집니다. 겨울철에는 주행거리가 크게 줄어드는 이유이죠.
고체 전해질, 에너지 밀도 높이고 안정성도 확보
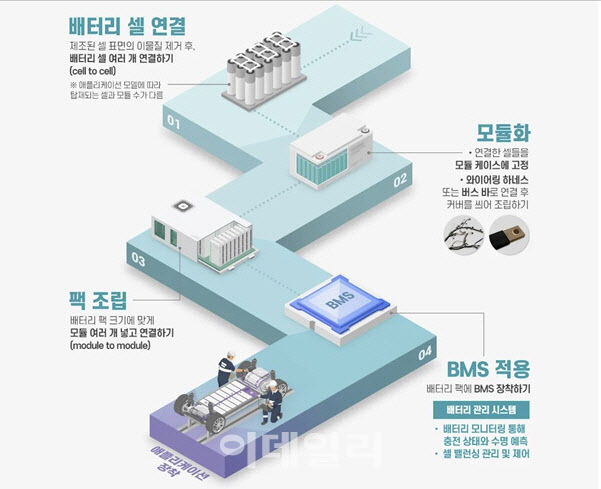
흔히 리튬이온 배터리에서는 4대 소재가 절반, 패키지가 절반이라는 이야기를 합니다. 배터리를 구성하는 4대 핵심 소재로 이뤄진 기본 단위를 ‘셀(cell)’이라고 하는데요. 일반적으로 전기차에 들어가는 배터리는 여러 개의 셀을 외부 충격이나 열, 진동 등에서 보호하기 위해서 프레임에 넣고 ‘모듈(module)’을 만듭니다. 또 여러 개의 모듈을 묶어 발화·폭발 위험성을 낮추기 위해 냉각(cooling)시스템, 배터리관리시스템(Battery Management System, BMS)등을 더해 ‘팩(pack)’으로 만듭니다.
|
간단하게 말하면 배터리 용량이 늘어나는 겁니다. 현재 리튬이온 배터리의 경우 1회 충전시 500~600km 주행할 수 있다고 하는데, 전고체 배터리는 주행거리가 1000km까지 늘어날 것으로 전망하고 있습니다. 또 불필요하게 발생하는 비용도 줄일 수 있습니다. 현재 리튬이온 배터리 소재·부품들의 원가 비중을 살펴보면, 실제 배터리 성능을 좌지우지 하는 4가지 핵심 소재에 투입되는 원가 비중은 약 36%에 이릅니다. 나머지 부분이 64%으로, 말 그대로 배보다 배꼽이 더 큰 상황이죠.
리튬메탈·리튬황배터리 핵심은 ‘고체 전해질’
물론 액체 전해질이 고체로 바꼈다고 해서 에너지 밀도가 획기적으로 높아지는 것은 아닙니다. 전고체 배터리가 ‘차세대 배터리’라고 불리는 또다른 이유는 고체 전해질을 기반으로 혁신적인 새로운 배터리를 구현할 수 있다는 점입니다. 대표적인 것이 리튬메탈배터리와 리튬황배터리입니다.
다만 리튬메탈 배터리는 충·방전을 거듭하면서 이온이 불균일하게 리튬 금속과 접촉하며 음극 표면에 적체되면서 뿌리처럼 자라나는 덴드라이트 현상 때문에 분리막이 훼손될 수 있습니다. 결정체가 분리막을 뚫고 양극에 닿으면 내부 단락이 발생, 화재로 이어질 수 있습니다. 업계에서는 상대적으로 이온의 움직임을 통제하기 쉬운 고체 전해질에서 이같은 문제점을 해결할 수 있다고 보고 있습니다.
|
하지만 리튬황배터리 역시 충·방전 과정에서 황과 리튬이 반응해 발생하는 황화리튬(리튬폴리설파이드)이 쉽게 전해질에 용해되면서 음극과 직접 반응해 새로운 표면층을 생성합니다. 이는 리튬 이온의 이동을 방해하고, 계속 축적되면 결국 분리막을 손상시키기도 합니다. 이 또한 고체 전해질이 문제 해결을 위한 중요한 열쇠를 쥐고 있습니다.
전고체 배터리가 상용화되기 위해선 아직 풀어야 할 숙제가 많습니다. 우선 고체 전해질의 소재, 활물질과 전해질 사이의 높은 표면 저항(계면 저항), 새로운 제조 공정 등을 고민해야 하는데요. 아무래도 리튬 이온이 흐르는 것이 아니라 고체 격자 사이를 이동하기 때문에 액체에 비해 고체 전해질은 이온 이동성이 떨어질 수밖에 없습니다. 따라서 이온 전도도를 높이기 위해서는 전해질과 양 극판의 접촉을 최대화하고 접촉면에서의 저항을 최소화해야 합니다.
현재 고체 전해질 소재의 경우 황화물계, 산화물계, 고분자계 등을 중심으로 연구가 활발하게 진행 중입니다. 이 중에서도 가장 빨리 상용화가 이뤄질 것으로 예상되는 것은 이온 전도도가 가장 뛰어난 황화물계입니다.
고분자계의 경우 생산은 쉽지만 이온 전도도가 낮고 저온 환경에서 성능이 저하되는 단점이 있습니다. 산화물계는 안정성이 우수하고 비교적 높은 이온 전도도를 보이지만 고온 열처리 공정이 요구돼 생산 용이성이 떨어진다는 단점을 갖고 있습니다. 황화물계도 수분에 취약하다는 단점은 있습니다. 수분에 노출되면 유독가스인 황화수소가스가 발생합니다. 이에 대한 관리 및 공정 시스템을 갖춰야지만 비로소 상업 생산이 가능해질 전망입니다.








![[포토]비상계엄 해제 후 한자리에 모인 한덕수 총리와 국무위원들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401092t.jpg)
![[포토]최상목 경제부총리, '어두운 표정'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400960t.jpg)
![[포토]청사들어서는 한덕수 총리](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400786t.jpg)
![[포토] 대통령실 입구의 취재진](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400817t.jpg)
![[포토]'긴급 의원총회 참석하는 추경호 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400571t.jpg)
![[포토]'긴박했던 흔적들'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400485t.jpg)
![[포토]조국, '국가 비상사태 만든 이는 尹...탄핵해야'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400366t.jpg)
![[포토]尹, '비상 계엄 해제할 것'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400277t.jpg)
![[포토]코스피-코스닥 동반 상승 마감](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300908t.jpg)
![[포토]따스한 온기를 퍼지는 행복촌](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300829t.jpg)




