20일 임상 시험 정보공개 사이트 클리니컬트라이얼즈에 따르면 유틸렉스는 올해 9월 주요 파이프라인 중 하나인 항체치료제 ‘EU101’의 임상 1·2상 자료 수집을 마치고 본격적인 데이터 분석에 들어간다.
EU101은 유틸렉스의 파이프라인 중 임상 단계가 가장 빠른 후보물질로, 올해 하반기 수집된 데이터 분석이 시작된 후 이르면 내년 또는 늦어도 내후년 초에는 임상과 관련한 초기 결과 확인이 가능할 것으로 예상된다.
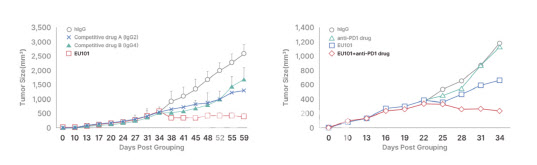
종료를 앞둔 임상은 고형암 환자 110명을 대상으로 안전성 및 유효성을 확인하는 한국·미국 통합 글로벌 연구다. 임상 1상에서는 56명을 대상으로 EU101의 투여 용량별 안전성을 살폈다. 임상 2상에서는 비소세포폐암(NSCLC) 및 결장직장암(CRC) 환자 54명에 대한 유효성을 확인 중에 있다.
임상 1상 중 저용량 투여군의 질병통제율(DCR)이 57.1%를 보이면서 효과성이 어느 정도 확인됐고, 고용량 투여시 더욱 높은 효과를 보였을 것으로 예상된다.
유틸렉스 관계자는 “현재 임상은 계획대로 진행 중”이라며 “임상 1상 등에서 좋은 결과를 보였기 때문에 2상 결과에 대한 기대를 가지고 있다”고 말했다.
EU101와 면역관문억제제 병용 등 다양한 전략 준비
또 유틸렉스는 EU101의 효과를 높이기 위해 현재 사용되는 면역관문억제제와 병용요법에 대한 부분도 고려 중이다. 이전에 실시된 동물실험 결과, 항PD-1 항체 키트루다와 병용투여한 그룹에서 단독투여보다 더 좋은 효과를 나타냈기 때문이다.
|
적극적 기술이전 추진 전망…매출 기준 채우고 적자 줄일까
유틸렉스는 임상 1·2상 데이터가 집계되고 구체적인 결과 도출이 기대되는 내년부터 본격적인 기술이전을 추진할 전망이다.
유틸렉스는 상장한 2018년 매출 4억원, 2021년 1억원, 지난해 2억원을 각각 기록했다. 아직 명확한 매출원이 없다. 매출 확보를 위해서는 기술이전이 필수적인 셈이다.
유틸렉스는 2017년 제지앙 화하이(절강화해제약, Zhejiang Huahai Pharmaceutical)와 EU101의 중국(대만, 홍콩, 마카오 포함) 지역 리서치, 개발, 상용화, 판매 등의 기술이전을 체결한 바 있어 이외 지역에서 추가 기술이전이 가능한 상황이다.
당시 EU101는 전임상 단계였는데, 총 계약규모 850만달러(약 100억원)에 계약금 100만달러(약 12억원)이었던 만큼 임상이 진행된 현재는 그 가치가 더 높아졌을 것으로 기대된다. 계약 조건에 따라 다를 수 있지만, 계약금 만으로 매출 30억원을 한방에 해결할 수도 있다.
추가 기술료 획득 가능성도 있다. 현재 제지앙 화하이는 EU101의 중국 임상 1상을 진행 중으로, 임상 종료 후 추가 임상에 나서는 경우 유틸렉스가 임상 단계에 따른 마일스톤을 수취하는 세부계약이 있다.
기술이전 또는 추가 기술료 획득을 통한 적자 폭 감소 효과도 기대된다. 유틸렉스는 그동안 연간 200억원대의 연구비용을 꾸준히 투자하면서 매년 적자 폭이 늘었다. 유틸렉스 영업적자는 2018년 137억원에서 2019년 183억원, 2020년 249억원, 2021년 336억원, 2022년 367억원으로 증가했는데 기술이전에 성공하는 경우 적자 폭이 줄어들 전망이다.
유틸렉스 관계자는 “올해 관리종목지정유예 기간 만료에 대한 부분을 인지하고 있으며 매출 확보를 위한 부분을 고민 중”이라며 “임상 진행 상황과는 별개로 기술이전에 대해서는 언제든 가능성을 열어두고 있다”고 말했다.








![[포토]윤석열 대통령 탄핵심판 첫 변론 준비기일 27일 예정대로 진행](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122400433t.jpg)
![[포토]'더불어민주당 원내대책회의'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122400387t.jpg)
![[포토]국무회의 입장하는 한덕수 권한대행](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122400378t.jpg)
![[포토]은행권 소상공인 금융지원 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300609t.jpg)
![[포토]인사청문회 출석한 마은혁 헌법재판관 후보자](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300404t.jpg)
![[포토]아침 영하 10도, 꽁꽁 얼어붙은 도심](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300843t.jpg)
![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)

![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)


