|
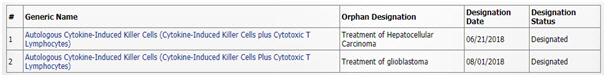
이뮨셀-엘씨는 2007년부터 국내 간암 항암제로 식품의약품안전처 품목허가를 얻어 생산·판매 중이다. 이번 희귀의약품 지정은 지난 6월 미국 간암에 이어 두 번째다.
회사는 2008년부터 뇌종양(교모세포종) 환자 180명에 대한 3상 임상시험을 진행하고 결과를 2016~2017년 논문(Oncotarget, Immunotherapy)에 발표한 바 있다.
‘이뮨셀-엘씨’는 환자 자신 혈액을 원료로 만드는 개인별 맞춤 항암제다. 약 2주간 배양 과정을 통해 항암기능이 극대화된 강력한 면역세포로 제조해 환자에게 투여하는 방식이다. 회사는 추가로 췌장암에 대한 희귀의약품 지정도 신청해 결과를 기다리고 있다.
이뮨셀-엘씨 외에도 차세대 세포치료제 ‘CAR-T’를 개발하고 있다. 환자 T세포를 체외에서 조작해 암세포 표면의 특정 단백질 항원을 인식하는 CAR를 면역세포 표면에서 생성, 환자에게 주입해 암세포만을 정확하게 공격하는 면역세포치료제다.
이득주 사장은 “미국 임상시험을 최소화해 비용과 시간을 절약하고 성공적으로 미국 시장에 진출하기 위한 전략을 구상 중”이라며 “이번 희귀의약품 지정을 통해 이뮨셀-엘씨의 미래가치를 인정받아 유리한 조건으로 FDA 허가를 받을 수 있을 것”이라고 말했다.








![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)
![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)

![40년간 아무도 예상치 못한 AI 붐에 대비한 '이 사람'[파워人스토리]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122300015h.jpg)
