|
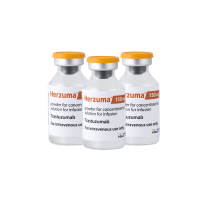
셀트리온은 13일(현지시간) 유방암 항체 바이오시밀러 허쥬마가 조기유방암, 전이성유방암, 전이성위암 등 오리지널 약인 허셉틴의 모든 적응증에 허가를 받았다고 밝혔다.
셀트리온은 지난해 12월 EMA 산하 약물사용자문위원회(CHMP)로부터 허쥬마의 허가승인 권고 의견을 받았다. 이번 승인으로 셀트리온은 자가면역질환 바이오시밀러 ‘램시마’ 혈액암 바이오시밀러 ‘트룩시마’에 이어 유럽시장에 3개의 바이오시밀러를 출시하게 됐다.
한편 셀트리온의 첫 바이오시밀러인 램시마는 2013년 EMA 허가 이후 4년여간 유럽에서 오리지널 의약품 시장의 49%를 점유할 정도로 성장했다. 지난해 2월 허가를 받은 트룩시마는 램시마보다 빠른 속도로 점유율을 높여가고 있다.
셀트리온 관계자는 “램시마가 퍼스트무버 바이오시밀러 마케팅으로 유럽에서 안정적으로 시장점유율을 높여가고 있고, 후속주자인 트룩시마가 판매 첫 해부터 급격하게 시장점유율을 높여가고 있어 세 번째 제품인 허쥬마에 대한 현지 의료진의 기대감도 높은 상황”이라며 “바이오시밀러 선도 기업으로 자리매김한 셀트리온 제품의 품질을 바탕으로 항암제 분야에서도 보다 많은 환자들이 합리적인 가격에 고품질 바이오의약품의 혜택을 누릴 수 있도록 시장점유율 확대에 최선을 다하겠다”고 말했다.








![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)

![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)


