|
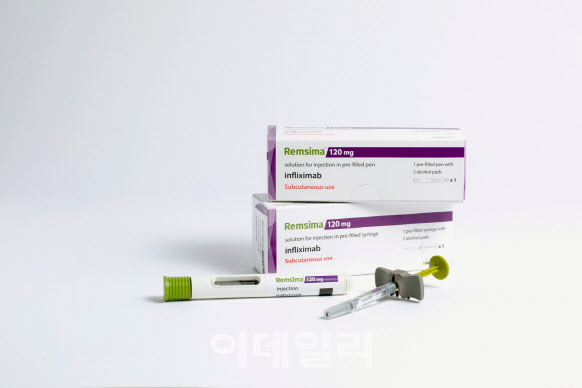
셀트리온은 25일(현지시간) 램시마SC를 염증성 장질환 치료제 등으로 사용할 수 있다는 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)의 ‘허가 승인 권고’ 의견을 받았다고 29일 밝혔다.
통상 유럽연합 집행위원회 최종 승인은 CHMP의 허가 승인 권고 후 1~3개월 내 이뤄진다. 이에 따라 큰 상황 변경이 없는 한 램시마SC는 조만간 기존 류머티즘 관절염 치료에 이어 장질환 치료제 등으로도 사용될 전망이다.
이번에 승인 권고를 받은 적응증(약 치료 대상)에는 성인을 대상으로 하는 크론병, 궤양성 대장염, 강직성 척추염, 건선성 관절염 및 건선(만성피부질환)이 포함돼 있다.
셀트리온 관계자는 “이번 CHMP 승인 권고로 램시마SC는 류마티스 관절염부터 성인 염증성 장질환 등까지 전체 인플릭시맙(램시마SC 성분) 시장에 진입하는 최초의 SC 제형 제품이 된 것”이라고 설명했다.
램시마SC는 기존 정맥주사형의 자가면역질환 치료제 램시마를 복부나 허벅지 등에 쉽게 자가 주사할 수 있게 피하주사형으로 개선한 제품이다. 기존 램시마SC는 류머티스 관절염 치료제로만 허가를 받았다.
셀트리온은 램시마SC로 전 세계 55조원에 이르는 자가면역질환 치료제 시장에서 약 20% 이상의 점유율로 10조원 이상의 매출을 달성하는 것을 목표로 하고 있다.
램시마SC는 지난 2월 독일을 시작으로 영국, 네덜란드 등에서 출시돼 있다. 셀트리온은 연말까지 유럽 주요 국가로 제품 출시를 확대할 예정이다.







![[포토]'국민의힘 의원총회'](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010800734t.jpg)
![[포토]테일러메이드, 신제품 Qi35시리즈 한국 런칭](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010800733t.jpg)
![[포토]외환시장 점검 간담회, '발언하는 최지영 국제경제관리관'](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010800653t.jpg)
![[포토]운영위 현안질의 불출석한 대통령실](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010800624t.jpg)
![[포토]최고위원회의, '모두발언하는 김민석 최고위원'](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010800518t.jpg)
![[포토]'비상 경제 안정을 위한 고위당정협의회 개최'](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010800492t.jpg)
![[포토]설 앞두고 장보기 주저돼~](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010700724t.jpg)
![[포토] 국립현대미술관 2025 전시계획 발표](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010700605t.jpg)
![[포토]따듯한 커피로 몸 녹이며 출근](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010700453t.jpg)
![[포토]원내대책회의 참석하는 박찬대-진성준](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010700431t.jpg)

![[포토] 메디힐 골프단 '최정상급 수준의 계약으로 최강 골프단 등극'](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2025/01/PS25010300073h.jpg)
![[속보]與, 김건희·내란 특검 재표결에 당론 부결 결정](https://image.edaily.co.kr/images/vision/files/NP/S/2025/01/PS25010800764h.jpg)
