28일 식품의약품안전청은 ‘피나스테리드’ 함유 제제 허가사항 변경안을 마련하고 해당 제품을 보유한 제약사들에 의견 제출을 요청했다. ‘이 약물을 복용하다 중단해도 발기부전이나 성욕감퇴 부작용이 지속될 수 있다’는 내용이 허가사항에 추가될 예정이다.
앞서 미국 식품의약품국(FDA)은 지난 4월 이같은 성기능 관련 부작용을 해당 제품의 허가사항에 반영한 바 있다.
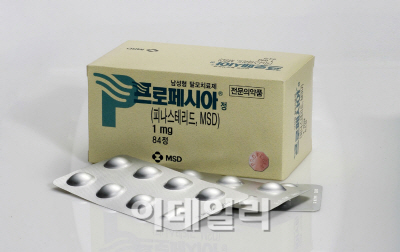
피나스테리드 성분 5mg을 함유한 MSD의 ‘프로스카’는 지난 1995년 전립성비대증치료제로 국내에 들어왔다. 이후 이 제품이 탈모에 효과가 있다는 점이 입증됐고 피나스테리드 1mg를 함유한 ‘프로페시아’가 탈모약으로 2001년 국내 허가를 받았다.
|
프로페시아의 지난해 국내 매출은 60억원 정도로 전립선치료제 프로스카(41억원)를 넘어선지 오래다. 이 같은 인기를 증명하듯 국내업체 50개사가 이미 프로페시아의 복제약을 발매했다.
프로페시아는 효능 뿐만 아니라 안전성을 높게 평가받으면서 환자들로부터 호평을 받았다.
식약청에 보고된 임상시험 결과 이 약물을 1년 복용한 환자 중 발기부전 부작용을 나타난 환자는 1.3%에 불과했다. 성욕감퇴, 사정량 감소 등 성기능 관련 부작용이 발생했지만 높은 비율은 아니었다.
하지만 ‘약물을 끊으면 부작용이 사라진다’는 인식을 뒤엎는 부작용이 이번에 반영된다.
투여를 중단해도 발기부전과 성욕감퇴, 정액의 질 저하 등이 지속될 수 있다는 부작용은 프로페시아를 복용중인 환자 입장에서는 적잖은 불안감으로 다가올 수밖에 없다.
다만 프로페시아와 지속되는 성기능 감퇴와의 연관성은 아직 밝혀지지 않았다. 약물 때문이 아니라 노화에 따른 자연스러운 현상일 수 있다는 추측도 나온다.
식약청 관계자는 “프로페시아와 성기능 부작용과의 연관 관계가 밝혀지지는 않았다”면서 “환자들은 전문의와의 상담을 통해 적절한 약물을 선택할 필요가 있다”고 말했다.






![[포토]교육부-보건복지부 장관, 의료개혁 관련 브리핑](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011000886t.jpg)
![[포토]제주항공 참사 합동분향소 10일 운영 종료](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011000832t.jpg)
![[포토]박종준 처장, 특수공무집행방해 혐의로 경찰 출석](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011000511t.jpg)
![[포토] 맘스홀릭베이비페어 전시](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010901108t.jpg)
![[포토]수도권 첫 한파주의보](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010901027t.jpg)
![[포토]'무죄'받고 이동하는 박정훈 전 수사단장](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010900998t.jpg)
![[포토]기자회견 하는 김상욱 의원](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010900987t.jpg)
![[포토]전국정당을 넘어 K-정당으로 향하는 더불어민주당](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010900948t.jpg)
![[포토]발언하는 권영세 위원장](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010900599t.jpg)
![[포토]포즈 취하는 팀테일러메이드](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010800134t.jpg)

![[포토]홍재경 아나운서,론칭쇼 진행합니다](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2025/01/PS25010800229h.jpg)


