미국 나스닥 바이오 상장사 바이오젠(티커 BIIB)의 주가가 부진하다. 미국 식품의약국(FDA) 승인을 받은 알츠하이머병 치료제 ‘아두헬름’의 판매가 시장의 예상치보다 부진하다는 분석이 주가에 반영된 것으로 풀이된다.
바이오젠은 지난 7월 2분기 실적 발표 보고서를 통해 아두헬름 매출액이 200만달러(약 23억원)라고 밝힌 바 있다. 알츠하이머병 치료제로 18년만에 FDA 승인을 받은 아두헬름을 개발했지만, 승인 절차와 효능에 대한 의구심이 작아지지 않으며 시장 기대보다 판매에 속도가 붙지 않고 있다.
|
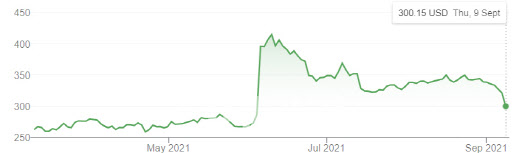
투자전문지 배런스(Barrons)는 바이오젠이 모건스탠리 글로벌 헬스케어 컨퍼런스에서 ‘아두헬름 판매 속도가 예상보다 느리다’고 말한 이후로 급락하고 있다고 10일(현지시간) 보도했다. 실제로 바이오젠은 9일(현지시간) 전 거래일 보다 21.40달러(6.66%)내린 300.15달러에 마감했다.
모건스탠리 글로벌 헬스케어 컨퍼런스는 매년 하반기 뉴욕에서 열리는 행사다. 유망한 바이오 기업을 초청해 글로벌 기관투자가와 매칭시켜준다. 올해는 9일부터 11일까지 사흘 동안 진행된다. 상반기 샌프란시스코에서 열리는 JP모건 헬스케어 컨퍼런스와 함께 양축을 이루는 바이오 투자자 유치 기업설명회(IR) 행사다.
|
동시에 바이오젠은 추가 데이터를 생성하기 위해 연구를 진행하고 있다고 밝혔다. 그는 “우리는 임상 데이터를 전달하기 위해 긴박감을 가지고 일하고 있다”며 “추후 연구 결과를 적절한 시점에 배포할 것”이라고 말했다.
지난 6월 바이오젠이 FDA로부터 획득한 승인은 ‘조건부 승인’으로 시판 후 효능과 안전성을 확인하는 임상 4상을 조건으로 내걸렸다. 여기서 효능을 입증하지 못하면 허가가 취소 될 수 있다. 따라서 추후 바이오젠이 공개할 추가 데이터에 주가 향방이 결정될 것으로 보인다.
美의회, FDA에 아두헬름 승인 관련 자료 요청
베타 아밀로이드가 축적되면 신경독성으로 알츠하이머 병리 증상이 진행된다는 가설을 바탕으로 한다. 지금껏 대형 글로벌 제약사들이 베타 아밀로이드를 공략하기 위해 노력했지만 모두 실패했다.
|
미국 의회는 아두헬름에 대한 추가 자료를 FDA에 요청한 상태다. 보나초스 바이오젠 대표는 “아두헬름 임상시험 결과는 정당했다”며 “FDA의 검토에 부정이 없었다”고 밝힌 상태다.
제프리 “매력적인 매수 기회”
현지 전문가들은 바이오젠의 현 주가가 저점으로 보고 있다. 현지 투자은행(IB) 제프리 애널리스트는 “약의 본격적인 유통까지 시장이 관심을 갖지 않을 수 있지만 주당 300달러까지 하락했고, 투자 심리가 부정적이어서 동시에 매력적인 매수 기회라고 생각한다”고 말했다. 제프리는 바이오젠에 대한 투자의견으로 ‘매수’와 목표가 주당 500달러를 제시한 상태다.
국내에서 알츠하이머병 치료제를 개발하는 곳은 △아리바이오 △젬백스앤카엘 △일동제약 △뉴로바이오젠 등이 있다. 국내 바이오 업체들은 바이오젠의 아두헬름 대비 효능을 자신하고 있어, 향후 FDA 승인 등에 있어서 자신감을 드러내고 있다.











![[포토]김세은 아나운서,따스한 햇살 받으며](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111600281t.jpg)
![[포토] 평창고랭지 김장축제](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111501303t.jpg)
![[포토] 종로학원, 대입 합격점수 예측 설명회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111501114t.jpg)
![[포토]이재명 민주당 대표 '징역 1년에 집행유예 2년'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111501110t.jpg)
![[포토]'구속VS무죄' 이재명 공판 앞두고 쪼개진 서초동](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111500881t.jpg)
![[포토] 개인정보보호위원회 기자설명회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111500752t.jpg)

![[포토]고생했어~](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111401524t.jpg)
![[포토] 걷고 싶은 거리](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111401206t.jpg)
![[포토] 광복 80주년 기념사업 시민위원회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111401169t.jpg)
![[포토]김세은 아나운서,진행은 매끄럽게](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111600282h.jpg)
![[이車어때]"8800만원짜리 드림카"…벤츠 AMG A 45 S 4MATIC+](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111600211h.jpg)


![예금자보호한도 24년만에 오른다고?[오늘의 머니 팁]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111600304h.jpg)