|
SK바이오팜은 9일 식품의약품안전처에서 3상 임상시험계획(IND)을 승인받았다고 밝혔다.
또한 중국 국가약품감독관리국(NMPA)에 세노바메이트 1상과 3상 임상시험계획서를 제출하고 승인을 기다리고 있다고 설명했다.
SK바이오팜은 또 10월 일본 후생노동성 산하기관인 의약품의료기기종합기구(PMDA)에 3상 임상시험계획서를 제출할 계획이다.
SK바이오팜은 각국 임상시험계획 승인절차가 완료되면 일본인, 중국인, 한국인 약 500명 이상을 대상으로 아시아 3상 임상시험을 진행할 예정이다.
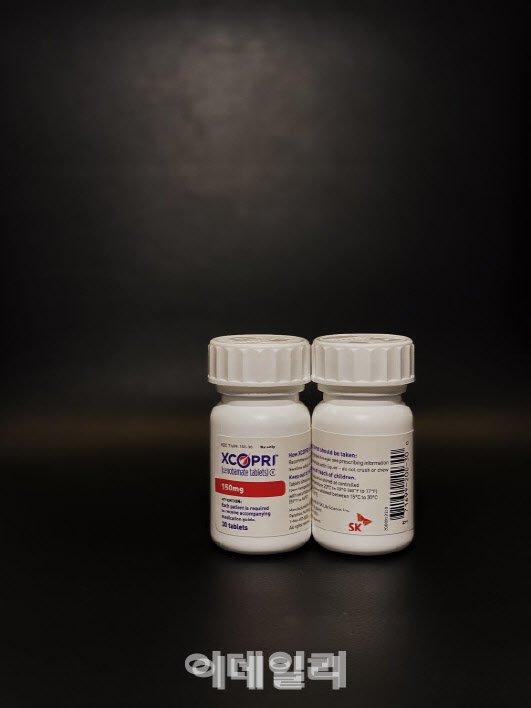
SK바이오팜이 독자 개발한 세노바메이트는 미국 식품의약국(FDA)로부터 승인받은 성인 대상 부분발작 치료제다. 지난 5월 미국 시장에 출시됐다. 판매는 SK바이오팜 미국 법인인 SK라이프사이언스가 하고 있다. 유럽에서는 의약청 품목허가 심사를 받고 있다.






![[포토] 조사 마친 윤석열 대통령](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011501678t.jpg)
![[포토] 코스피, 코스닥 내림세...](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011501243t.jpg)
![[포토]'내란 우두머리 피의자' 윤석열 대통령 공수처로 이동](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011501058t.jpg)
![[포토] 네스프레소 2025 캠페인 론칭 토크쇼](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011501014t.jpg)
![[포토] '와일드무어' 미디어 행사](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011501005t.jpg)
![[포토]공수처 차고로 들어가는 윤 대통령 차량](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011500861t.jpg)
![[포토]사다리로 차벽 넘는 공수처](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011500701t.jpg)
![[포토]공개된 팰리세이드 풀체인지](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011500422t.jpg)
![[포토]공공기관 채용정보박람회 개최…“신규채용 2만4000명 추진”](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011400899t.jpg)
![[포토] 설 명절 자금 방출](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011400672t.jpg)

![[포토]박현경,백여 명의 팬들과 즐거운 출정식 개최](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2025/01/PS25011200149h.jpg)


