|
26일 제약·바이오업계에 따르면 지난달 9일 휴젤은 중국 국가식품의약품감독관리총국(NMPA)에 ‘레티보’에 대한 보완자료 제출을 완료했다. 레티보는 휴젤의 주력 보툴리눔 톡신 제제인 ‘보툴렉스’ 수출명이다. 현재 NMPA가 보완자료 검토를 통해 허가 심사를 진행하고 있는데, 대기 순번이 16번인 것으로 전해졌다. 앞서 휴젤은 지난해 4월 중국 보건·의료당국에 보툴리눔 톡신 제제 판매 허가를 신청했다.
중국은 란주연구소가 BTX-A라는 보툴리눔 톡신 균주를 독자 보유하고 있어 다른 나라 보툴리눔 톡신 제제에 대해 까다롭게 심사하는 것으로 알려졌다. 하지만 최근 프랑스 입센사(社) ‘디스포트’가 중국 규제당국 승인을 받으면서 중국 내 수입산 톡신 제제에 관한 허가 불확실성이 해소되는 분위기다.
공교롭게도 휴젤은 NMPA에 레티보 보완자료를 낸 지난달 9일 NMPA가 주최하는 ‘빈곤 퇴치 간담회’에 참석했다. NMPA 부국장 등 고위직은 물론 알리바바·텐센트·화윤·국약·징동 등 중국 현지 기업과 피앤지·글락소스미스클라인·아스트라제네카·노바티스·로레알 같은 다국적 제약사 50여 곳을 상대로 회사 소개 및 대표제품 보툴리눔 톡신·HA필러를 소개하는 시간을 가졌다.
|
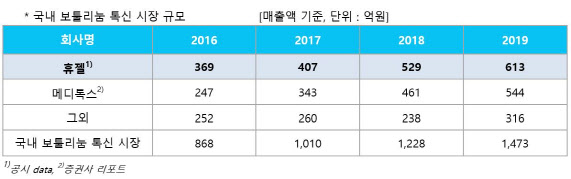
국내 보툴리눔 톡신 제제 이른바 ‘보톡스’ 시장은 1위인 휴젤을 비롯해 2위 메디톡스(086900)와 3위 대웅제약(069620)이 ‘빅3’를 형성하고 있다. 하지만 2·3위 업체가 흔들리면서 휴젤의 행보에 업계 이목이 집중되는 분위기다. 메디톡스의 ‘메디톡신’은 식품의약품안전처로부터 품목 허가 취소를 받아 국내 영업에 위기를 맞았다. 대웅제약의 ‘나보타’(수출명 주보)는 국제무역위원회(ITC)의 10년간 수입 금지 예비 결정으로 인해 미국 수출에 빨간불이 켜진 상황이다.
|
휴젤은 한국 영업 강화와 동시에 해외시장 다변화 전략을 추진하고 있다. 중국 외에도 지난달 30일 유럽의약품청(EMA)까지 판매 허가 신청을 마쳤다. 이미 휴젤은 작년 1월 유럽 유통 파트너사인 ‘크로마’와 함께 폴란드·독일 임상 3상을 마무리했다. 신청서 제출 이후 심사기간이 약 1년여 소요된다는 점을 감안하면 내년 하반기 전후 유럽 시판 승인을 획득할 전망이다.
휴젤 관계자는 “연말께 미국 진출을 위한 생물의약품 허가신청서(BLA)를 미(美) 식품의약국(FDA)에 제출할 계획”이라며 “내년 연말까지 미국·유럽·중국 등 글로벌 ‘빅3’ 국가의 판매 허가 취득 완료를 목표하고 있다”고 말했다.









![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)
![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)



