SK바이오사이언스는 내년 1분기 3상 중간분석 결과가 도출된 뒤 허가 신청에 나설 예정이다. SK바이오사이언스가 비교임상에서 유효성을 입증하면 국산 첫 코로나19 백신으로 승인을 받을 가능성이 높다.
식약처, SK바이오사이언스 GBP510 3상 승인
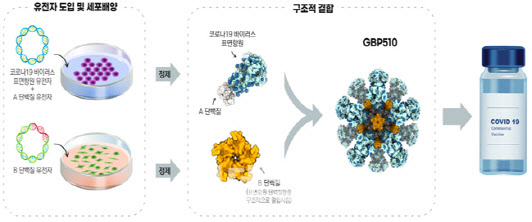
10일 식약처는 국내 개발 코로나19 백신인 SK바이오사이언스의 ‘GBP510’의 임상시험 계획을 승인했다고 밝혔다. 김강립 식약처장은 이날 브리핑에서 “이번 승인으로 국내 업체가 개발한 코로나19 백신이 최초로 3상에 진입하게 됐다”며 “앞서 허가된 백신과의 비교로 효과를 입증하는 비교임상 방식으로는 세계에서 2번째로 3상을 진행하게 된다”고 설명했다.
|
김 처장은 “현재 임상 2상이 진행 중이나 1상에서 안전성과 면역원성이 충분히 나타나 임상 3상 진입 가능성을 보여줬다”며 “안전성 측면에서는 백신 접종 시 일반적으로 나타나는 통증과 피로 등 이상사례 외 특별한 부작용은 보고되지 않았다”고 설명했다. 이번 3상 임상시험은 국내뿐만 아니라 동남아시아, 동유럽 등 여러 나라에서 동시에 진행될 예정이다.
“비교임상 필수불가결해…국제 표준 주도할 것”
이번에 승인한 임상시험은 현재 국내에서 허가돼 예방접종에 사용하고 있는 아스트라제네카(AZ) 백신을 대조백신으로 사용해 시험 백신의 효과를 확인하는 비교임상 방식으로 진행된다. 지난 4월 프랑스 제약사 발네바가 개발한 코로나19 백신이 아스트라제네카 백신을 대조군으로 하는 비교임상 3상을 승인받아 영국에서 임상을 시작한 바 있다.
김 처장은 “대조백신은 허가된 코로나19 재조합 백신이 없는 상황을 고려해 바이러스벡터 방식인 아스트라제네카 백신을 선정했다”며 “중화항체가(특정 바이러스를 중화할 수 있는 항체의 양)의 우월성과 혈청반응률의 비열등성을 확인하는 것으로 설계됐다”고 설명했다.
|
최초로 국산 코로나19 백신이 3상 임상에 돌입하면서, 국내 백신 자급화를 위한 첫걸음을 내딛었다는 데 의의가 있다는게 식약처의 설명이다.
김 처장은 “글로벌 백신 선도 기업이 없는 국가임에도 국내 개발 코로나19 백신에 대한 임상 3상을 승인했다”며 “아직 면역대리지표(ICP)가 정립되기 전이지만 전통적인 위약임상으로 국제적인 임상 3상을 하기가 쉽지 않은 상황에서 적극적이고 면밀한 심사로 비교임상 방식을 추진했다”고 말했다.
증권가에서도 SK바이오사이언스의 코로나19 개발 성공 가능성을 높게 보고 있다.
박병국 NH투자증권 연구원은 이날 보고서를 통해 “국제민간기구 감염병대응혁신연합(CEPI)으로부터 2000억 원의 3상 비용을 펀딩하고 내년 상반기 긴급사용 승인이 목표”라며 “시장성에 대한 우려가 있지만 실제 공급 데이터를 보면 충분한 기회가 있다고 판단하고, 자체 코로나19 백신 성공 가능성을 높게 본다”고 말했다.








![[포토] 불길 휩싸인 여객기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122900445t.jpg)
![[포토]출렁이는 환율 시장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122900259t.jpg)
![[포토]겨울아 반가워](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122900232t.jpg)
![[포토]윤 대통령, '공수처 3차 소환 불응'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122900095t.jpg)
![[포토]한덕수 대통령 권한대행 국무총리 탄핵소추안 투표하는 우원식 국회의장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700978t.jpg)
![[포토] 달러 상승 이어져...](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700871t.jpg)
![[포토] 헌법재판소 소심판정](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700760t.jpg)
![[포토] 정청래 단장과 김이수 전 헌법재판관](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700742t.jpg)
![[포토] 윤석열 법률대리인 헌재 출석](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700731t.jpg)
![[포토]내수경기활성화 민당정협의회 열려](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700609t.jpg)
![[포토]윤이나,후배 양성을 위해 2억원 기부했어요](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122600088h.jpg)

!["우리 언니 살아있는 거 맞아요?"…통곡으로 가득 찬 무안공항[르포]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122900418b.jpg)

