|
15일 식품의약품안전처의 의약품통합정보시스템 의약품안전나라에 따르면, 지난 10일 현재 GC5131에 대해 총 38건의 치료 목적 사용 승인이 이뤄졌다.
‘치료목적사용승인’은 다른 치료 수단이 없거나 생명을 위협하는 중증 환자 등의 치료를 위해 허가되지 않은 임상시험용 의약품이더라도 사용할 수 있게 하는 제도다.
지난해 10월 칠곡경북대병원이 최초로 GC5131의 치료 목적 사용 승인을 받은 바 있다. 이는 전세계에서 개발 중인 코로나19 혈장치료제가 임상시험에 참여하는 코로나19 환자가 아닌 개별 환자에 사용된 첫 사례였다.
현재 GC녹십자는 GC5131의 임상 2a 시험을 끝낸 뒤 데이터를 분석 중이다.
혈장치료제는 코로나19 회복기 환자 혈장에서 항체가 들어 있는 면역 단백질만 걸러내 고농도로 농축해 만든 의약품이다.








![[포토]긴급현안질의, '답변하는 박안수 육군참모총장'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120500534t.jpg)
![[포토]서울 지하철, '계엄 파문 속' 3년 연속 파업](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120500482t.jpg)
![[포토]최고위, '모두발언하는 박찬대 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120500479t.jpg)
![[포토]최고위, '모두발언하는 한동훈'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120500432t.jpg)
![[포토]골프존 파스텔 합창단,지역주민위한 공연](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400127t.jpg)
![[포토]국회 월담하는 우원식 국회의장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401332t.jpg)
![[포토]'규탄사하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401162t.jpg)
![[포토]비상계엄 해제 후 한자리에 모인 한덕수 총리와 국무위원들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401092t.jpg)
![[포토]최상목 경제부총리, '어두운 표정'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400960t.jpg)
![[포토]청사들어서는 한덕수 총리](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400786t.jpg)



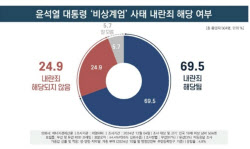
![국민 10명 중 7명 尹 탄핵 찬성…부산·대구에서도 60% 이상[리얼미터]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120500353h.jpg)
