|
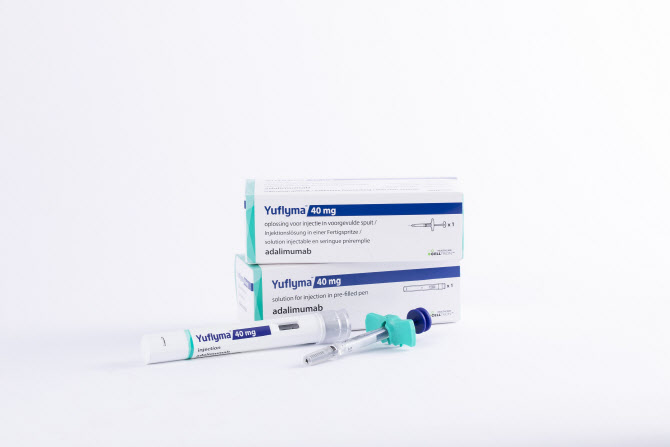
[이데일리 나은경 기자]셀트리온(068270)은 지난 22일(현지시간) 유럽 규제기관에 자가면역질환 치료제 ‘CT-P17’(성분명 아달리무맙, 이하 유플라이마)과 오리지널 의약품 휴미라 간 상호교환성(interchangeability) 확보를 위한 글로벌 3상 임상시험계획을 제출했다고 23일 밝혔다.
셀트리온은 에스토니아, 폴란드 등 유럽 다수 국가에서 판상 건선 환자 366명을 대상으로 글로벌 3상 임상시험을 진행할 예정이다. 유플라이마와 휴미라 간 다회교차 투약군과 휴미라 유지 투약군 간의 약동학, 유효성, 안전성 등을 비교 검증할 계획이다.
추가로 미국에서도 내년 7월 1일부터 판매에 돌입할 수 있도록 개발사인 애브비(Abbvie)와 미국내 특허 합의를 완료한 상태로 연내 미국 식품의약국(FDA)의 판매 허가를 기대하고 있다. 셀트리온은 미국내 유플라이마의 본격적인 판매가 시작되면 고농도 제형의 장점과 함께 인터체인저블(Interchangeable) 바이오시밀러 지위 확보 여부와 다양한 적응증에 대한 임상 결과도 향후 중요한 경쟁력으로 작용할 것으로 보고 있다.
셀트리온이 개발한 유플라이마는 EMA로부터 허가를 획득한 최초의 고농도 휴미라 바이오시밀러로, 저농도 대비 약물 투여량을 절반으로 줄이고 통증을 유발할 수 있는 시트르산염(구연산염)을 제거한 것이 특징이다.
셀트리온 관계자는 “유플라이마가 상호교환성 임상을 통해 인터체인저블 바이오시밀러 지위를 확보하면 경쟁력 강화로 시장점유율 확대에도 큰 도움이 될 것”이라며 “임상과 허가 준비에 만전을 기하고 글로벌 시장에 합리적인 가격의 고품질 바이오의약품 공급을 진행할 수 있도록 최선을 다하겠다”고 말했다.








![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)
![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)



