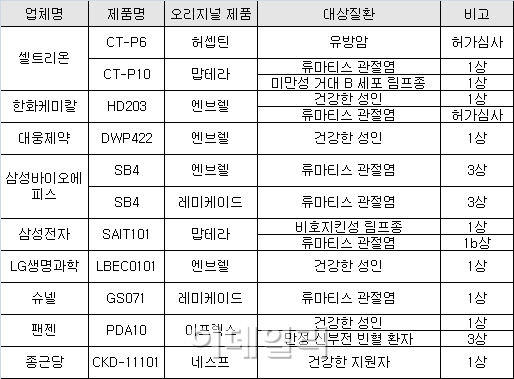
특히 국내 최초의 항체 바이오시밀러(바이오복제약)인 셀트리온(068270)의 ‘램시마’는 본격적으로 국제 무대에서 검증을 받게 된다. 램시마는 유럽에서 20억달러의 매출을 기록중인 레미케이드의 유일한 복제약이다. 셀트리온은 지난해 6월 유럽의약품청(EMA)으로부터 램시마의 허가를 받고 유럽 발매를 준비하고 있다.
7일 셀트리온 관계자는 “현재 램시마의 판매가 가능한 국가는 27개국으로 각국의 오리지널 약 판매를 근거로 추정한 시장규모는 3000억원에 달한다”면서 “올 하반기에는 캐나다, 러시아, 브라질 등 거대 시장에도 램시마의 발매가 시작될 것으로 예상된다”고 말했다. 램시마는 국내 시장에서 발매 1년 동안 17억원의 매출을 올리며 상승세를 보이고 있다.
램시마에 이어 바이오시밀러 2·3호도 연내 발매가 예상된다.
한화케미칼(009830)이 개발중인 ‘엔브렐’의 바이오시밀러 ‘HD203’가 식품의약품안전처의 최종 승인이 임박했다. 한화케미칼은 지난 2012년 9월 이 제품의 허가를 신청했고 식약처는 주요 안전성과 유효성 검토를 끝내고 막바지 심사를 진행중인 것으로 알려졌다.
셀트리온의 두 번째 바이오시밀러 제품도 연내 허가가 유력하다. 셀트리온은 유방암치료제 ‘허셉틴’의 바이오시밀러 개발을 위한 임상시험을 마치고 지난해 9월 식약처에 허가를 신청했다.
신성장동력으로 기대를 모았던 줄기세포치료제는 시장에 판매중인 3개 품목의 성패 여부가 윤곽을 드러낼 것으로 예상된다.
지난 2011년 7월 파미셀의 심근경색치료제 ‘하티셀그램-AMI’가 첫 줄기세포치료제로 허가받았고 메디포스트의 무릎연골결손치료제 ‘카티스템’과 안트로젠의 크론병치료제 ‘큐피스템’이 각각 2012년 1월 허가받은 바 있다.
이들 제품 모두 아직까지 시장에서 폭발적인 성장세를 보이지 못하고 있다. 줄기세포치료제가 치료 현장에서 효과가 완벽하게 검증되지 않았을 뿐더러 고가의 치료비로 대중화가 쉽지 않다는 이유에서다.
환자 수가 많지 않은 큐피스템은 건강보험 급여가 적용 여부가 관건이다. 안트로젠은 지난 2012년 보건당국에 큐피스템의 보험급여를 신청했고 현재 심의가 진행중이다.
4호 줄기세포치료제의 등장은 내년 이후로 미뤄질 전망이다. 현재 8개 업체가 18개의 줄기세포치료제의 임상시험을 진행중이지만 현재 식약처에 허가신청이 접수된 품목은 없는 것으로 나타났다.
|
▶ 관련기사 ◀
☞[마감]코스닥, 한달만에 500선 회복..비트코인株 '들썩'
☞[마감]코스닥 500선 근접..코스피와 차별화
☞[특징주]셀트리온, 강세..매각 기대








![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)

![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)


