5일 카이노스메드에 따르면 KM-819는 이르면 1분기 중 두 가지 적응증을 타깃으로 임상 2상 첫 환자 투약을 개시할 예정이다. 2015년 한국화학연구원으로부터 카이노스메드가 라이선스인 한 KM-819는 현재 파킨슨병 치료제를 타깃으로 한 미국 임상 2상과 다계통위축증(MSA) 치료제를 타깃으로 한 국내 임상 2상을 동시 추진 중이다.
파킨슨병 근본치료제로 ‘혁신신약’ 노린다
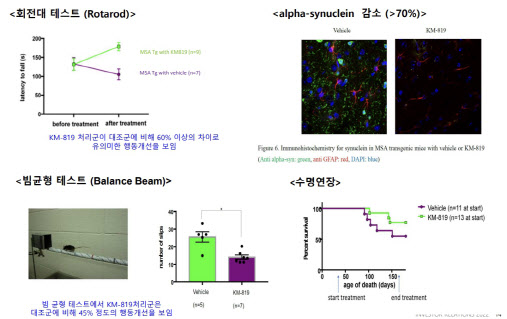
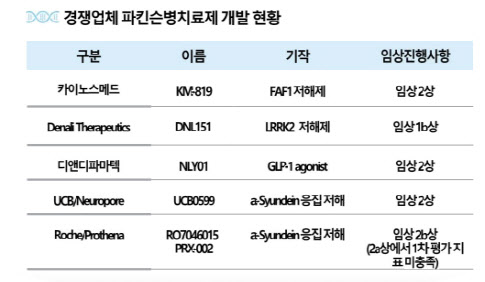
카이노스메드가 개발 중인 KM-819는 현재 허가된 약이 증상완화제뿐인 글로벌 파킨슨병 시장에서 ‘혁신신약’(first-in-class) 지위를 노리고 있다. 파킨슨병은 독성이 있는 알파-시뉴클라인(aSyunclein) 단백질의 축적이 발병 원인 중 하나로 알려져 있다. 많은 글로벌 빅파마들이 알파-시뉴클라인을 직접 타깃하는 신약 연구에 몰두했지만 관련 임상들이 잇따라 실패한 바 있다. 반면 세포의 죽음을 촉진하는 단백질 FAF1을 타깃하는 KM-819는 FAF1 과발현을 억제해 도파민 신경세포의 사멸을 막고, 자가포식을 활성화시켜 알파-시뉴클라인 응집까지 억제한다는 점에서 주목을 받는다.
|
회사 관계자는 “계획이 변수없이 진행될 경우 하반기 중에는 파트2 환자 투약 개시도 가능할 것”이라며 “알파-시뉴클라인을 직접 타깃하는 바이오젠과 GS(Glucosylceramide Synthase)를 타깃하는 사노피가 임상 2상을 자발적으로 중단하면서 KM-819처럼 신경세포보호와 알파-시뉴클라인에 동시 접근하는 방식이 업계에서 주목받고 있다”고 설명했다.
임상 2상 파트2는 파킨슨병 환자 288명을 대상으로 KM-819를 2년간 투여하는 것을 골자로 한다. 앞서 진행된 파킨슨병 임상 중 가장 큰 규모로 진행되므로 통계적 유의성을 확보하는 데 용이할 전망이다. 글로벌 시장조사업체 글로벌데이터(Global Data)에 따르면 주요 7개국(미국, 일본, 프랑스, 독일, 이탈리아, 스페인, 영국)의 파킨슨병 시장은 오는 2029년 115억달러(14조6000억원) 규모까지 성장할 것으로 추정된다.
“MSA치료제, 국내 임상 결과로 FDA 갈 것”
|
MSA는 몸이 뻣뻣해지고 움직임이 느려지는 파킨슨병 증상과 비틀거리며 말을 더듬는 소뇌 증상이 동반되는 신경 질환이다. 초기 증상이 파킨슨병과 유사해 구분이 어려운데 증상 진행속도는 더 빠르다. 일반적으로 첫 징후 증상이 나타난 이후 기대여명이 평균 8년 수준으로 알려져 있다. 치료가 시급한 희귀난치성 질환인 만큼 회사측은 임상 2상 후 희귀의약품 지정 가능성을 기대하고 있다. 마지막 환자 등록 후 19개월 간 투약을 진행하면 임상 2상이 종료되는데 마스터 임상인 최초 9개월의 투여 후 1차 평가가 예정돼 있다.
해당 임상은 국내에서만 진행되지만 회사측은 임상 2상 결과를 토대로 미국에서 글로벌 임상을 진행할 수 있을 것으로 기대하고 있다. 회사 관계자는 “국내에서만 진행되는 임상이지만 글로벌 임상시험수탁기관(CRO)이 미국 FDA 기준에 맞춰 진행하는 것이고, 내부적으로는 KM-819 작용기전이 인종간 차이가 없다고 보고 있다”며 “MSA는 희귀질환으로서 환자들에게 선택지가 많지 않기 때문에 임상 2상 결과가 좋을 경우 이 내용으로 미국에서 임상 3상 허가를 받을 가능성이 열려 있다”고 말했다.








![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)
![[포토] 주식시장 활성화 테스크포스-경제계 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900547t.jpg)
![[포토]최재해, '정치적 탄핵 매우 유감...자진 사퇴 생각 없다'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900431t.jpg)
![[포토]'모두발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900370t.jpg)
![[포토]이데일리 퓨처스포럼 송년회 무대](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801622t.jpg)
![[포토]용산국제업무지구 개발계획 공동협약식에서 협약서 서명](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801123t.jpg)
![[포토]이틀 연속 폭설에 눈 쌓인 북한산](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801096t.jpg)
![[포토]서울리빙디자인페어 in 마곡](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112800810t.jpg)


!['수천억 차익' 하이브 상장 전 '주주간계약' 논란…쟁점은[마켓인]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112900651b.jpg)

