|
중증 천식 조절제로 급부상한 생물학적제제 6종
7일 제약바이오 업계에 따르면 세계 50조원 안팎의 천식치료제 시장은 장기 조절용 유지 요법제(장기 조절제)와 속효성 단기 증상 완화제(속효성 완화제)로 구분되고 있다. 전자는 장기적으로 천식을 관리하는 데 사용되는 약물이며, 후자는 빠르게 천식 증상을 없애는 데 쓰인다.
일반적으로 중증 천식 환자의 증상 조절을 위한 흡입형 스테로이드와 기관지 확장을 위한 ‘살메테롤’ 성분의 약물을 각각 투여하며, 상태에 따라 용량을 높여간다. 여기에 경구용 코르티코스테로이드 치료를 병행하게 된다. 하지만 이런 약물을 고용량으로 장기 복용하면 당뇨나 고혈압 등 부작용을 겪을 위험이 큰 것으로 알려졌다.
최근 이런 환자의 치료를 위해 생물학적제제가 강세를 이어가고 있다. 여기에는 미국 승인 순으로 △스위스 노바티스의 ‘졸레어’(오말리주맙, 2003년) △영국 글락소스미스클라인(GSK)의 ‘누칼라’(성분명 메폴리주맙,2015년) △이스라엘 테바의 ‘싱케어’(성분명 레슬리주맙, 2016년) △AZ의 파센라(벤라리주맙, 2017년) △듀피젠트(성분명 두필루맙, 2018년)△테즈스파이어(성분명 테제펠루맙, 2022년) 등이 포함된다. 이들 6종이 미국이나 유럽, 일본 등 주요국에서 두루 승인돼 널리 활용되고 있다.
각사에 따르면 지난해 3분기 매출 기준 듀피젠트가 23억3000만 달러(한화 약 2조9260억원)로 1위를 차지했다. 누칼라(10억 2800만 달러), 파센라(10억 1500만 달러), 졸레어(3억 2200만 달러) 등이 뒤를 이었다.
사용범위 大, 장기 사용 부작용↓...‘듀피젠트’가 강세
최근 피하주사용 듀피젠트가 천식 시장에서 빠르게 시장성을 높여가고 있다는 분석이 나온다. 지난해 9월 사노피는 유럽호흡기학회(EPS)에서 듀피젠트를 중증 천식 환자에게 2주 간격으로 96주간 주사할 경우 증상이 81% 이상 개선됐으며, 부작용이 큰 코르티코스테로이드 사용량도 70% 이상 줄였다고 발표했다. 아토피 치료제로 유명한 듀피젠트가 중증 천식 시장에서도 강한 성장세를 이어가는 이유로 꼽힌다.
이밖에도 기존 치료제에 조절되지 않는 중증 천식 환자를 대상으로하는 듀피젠트는 세부 적응증면에서 강점이 있다. 졸레어나 파센라는 각각 순서대로 중증 알레르기성 천식과 중증 호산구성 천식 환자에 특화돼 있어 범용성이 떨어졌다. 싱케어 역시 중증 호산구성 천식환자에 특화된 약물이며, 피하주사로 개발된 경쟁제제와 달리 병원 방문이 필요해 접근성이 떨어지는 정맥주사형으로 개발됐다.
국내 천식 치료제 개발 업계 관계자는 “천식의 원인이 복잡해 각종 생물학적제제를 대체 투여하는 처방이 활발하게 이뤄진다”며 “2019년 이후 비교적 뒤늦게 출시된 듀피젠트가 기본적인 적응증 면에서 활용범위가 넓어, 처방량이 빠르게 늘고 있다”고 말했다. 아토피 피부염 치료제로 개발된 듀피젠트는 미국이나 유럽 등 주요국에서 2018~2020년 사이 중증 천식 관련 적응증을 확대하는 데 성공했다.
|
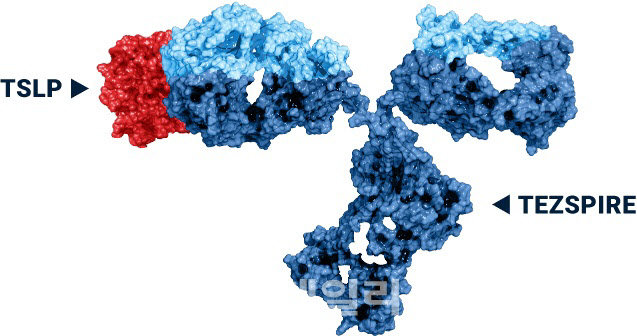
이런 상황에서 지난 2일(현지시간) AZ는 암젠과 공동개발한 테즈스파이어의 펜 제형이 12세 이상 중증 천식환자의 치료제로 유럽에 이어 미국에서도 승인됐다고 발표했다. 해당 제형은 자가투여 가능한 일회용 용량으로 알려졌다.
테즈스파이어는 ‘흉선 기질상 림포포이에틴’(TSLP)라는 신호전달 물질을 차단해 염증의 연쇄 반응을 막는 기전을 가진 신약이다. 특히 이 약물의 임상 3상 결과, 혈액 호산구 수치, 알레르기 상태, 호기산화질소(FeNO)를 비롯한 주요 바이오마커에 관계없이 광범위한 중증 천식 환자를 대상으로 사용 효과를 입증하며 주목을 받았다.
루드 도버 AZ 바이오의약품사업부 부사장은 “테즈스파이어 펜 제형을 통해 환자가 집에서 스스로 천식을 관리하는 것이 가능해졌다”며 “우리 약물말고도 펜제형이 개발됐지만 천식을 일으킨 원인에 관계없이 범용으로 사용할 수 있는 장점이 있다. 시장에서 우리 약물에 대한 호응이 클 것으로 기대한다”고 말했다.
국내에서는 테즈스파이어를 제외한 5종의 생물학적제제가 중증 천식 치료 적응증으로 도입된 상황이다. 이에 국가임상시험재단은 지난해 12월 테즈스파이어와 AZ의 루푸스 치료제 ‘사프넬로’ 등을 국내 우선 도입이 시급한 1순위 신약으로 선정한 바 있다.
한편 세계 중증 천식 시장 진출을 위해 국내사 중 셀트리온이 졸레어 바이오시밀러 후보물질 ‘CT-P39’의 글로벌 임상 3상을 진행하고 있다. 2007년경 시장에 출시된 졸레어의 물질특허는 유럽과 미국에서 각각 2024년과 2025년에 만료된다. 미국 클리니컬트라이얼에 따르면 CT-P39의 미국 내 임상 3상은 오는 6월 최종 투약 환자의 2차 효능 측정 및 부작용 등과 관련한 데이터 집계가 완료될 예정이다.








![[포토]코스피-코스닥 동반 상승 마감](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300908t.jpg)
![[포토]따스한 온기를 퍼지는 행복촌](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300829t.jpg)
![[포토]이웃을 위한 연탄나눔봉사활동](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300804t.jpg)
![[포토]한동훈, '여성의 힘으로 세상을 바꾸자'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300792t.jpg)
![[포토]설영희부띠끄 24W/25S 살롱 패션쇼](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300633t.jpg)
![[포토]유승민 "대한체육회장 공식 출마합니다"](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300064t.jpg)
![[포토]더불어민주당 원내대책회의](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300465t.jpg)
![[포토]'모두발언하는 추경호 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300359t.jpg)

![[포토]의정갈등에 피해는 환자에게…](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200764t.jpg)



![[단독]공정위, 中 '알테쉬' 제재 절차 밟는다…과징금 규모는](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120300940h.jpg)
