|
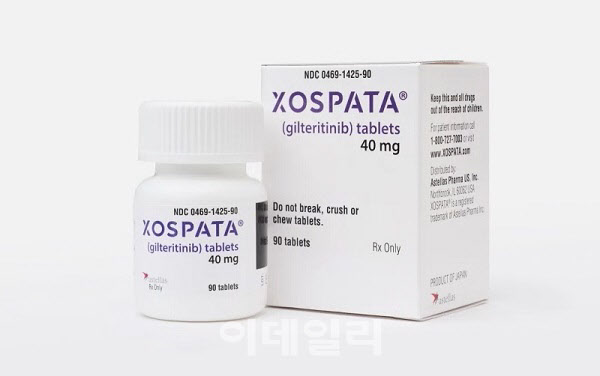
일본 아스텔라스제약(아스텔라스)의 급성골수성백혈병(AML) 치료제 ‘조스파타’(성분명 길테리티닙)가 지난해 약 458억엔(한화 약 4500억원)의 매출을 올리며 전년 대비 34%가량 큰 폭으로 성장한 것으로 알려졌다. 조스파타는 아스텔라스가 보유한 약물 중 ‘엑스탄디’(성분명 엔잘루타마이드)에 이어 두 번째로 높은 매출을 기록했다.
혈액암 중 가장 흔한 AML은 전체 백혈병 중 약 50~60%를 차지하며, 첫 진단후부터 사망까지의 전체 ‘생존기간 중앙값’(mOS)이 채 1년이 되지 않는다. FLT3 유전자 돌연변이는 AML 환자 중 20~30%에서 관찰되는 것으로 확인되고 있다. 매년 신규로 발생하는 백혈병 환자는 1500명 수준이며, 이중 약 400명이 FLT3 돌연변이를 보유하는 것으로 알려졌다.
국내에서는 조스파타 단독요법에 대해 지난해 3월부터 최대 4주기(4달) 치료까지 보험 급여가 적용되기 시작했다. 건강보험심사평가원에 따르면 조혈모세포이식이 가능해 치료적 이득이 큰 환자에게만 관해유도요법으로서 조스파타 단독요법의 2주기 투여를 급여로 인정했다. 또 조혈모세포이식 준비기간을 고려해 2주기 투약 후 부분반응(PR) 이상을 보이면서 동종조혈모세포이식 사전승인을 받은 경우(또는 이에 준하는 입증자료를 제시한 경우)에 한해 추가 2주기 투여에 대해서도 급여 인정한 것이었다.
한편 조스파타의 경쟁약물로 일본 다이이찌산쿄가 개발한 ‘반플라타’(성분명 퀴자티닙)와 스위스 노바티스의 ‘라이답’(성분명 미도스타우린) 등이 있다.
먼저 반플라타는 2019년 일본에서 승인돼 출시됐다. 다이이찌산쿄가 FDA 및 EMA 등에 각각 지난 2021년 6월과 10월 반플라타의 성분인 퀴자티닙에 대한 FLT3 변이 재발 또는 불응성 AML 적응증 승인을 신청했지만 한 차례 거부됐다. 회사 측은 이에 굴하지 않고 재진입 절차를 밟았고, 현재는 미국와 유럽에서 퀴자티닙에 대한 허가 심사를 받는 중이다. 미국 내에서 퀴자티닙의 승인 결론은 FDA가 지난 4월 한 차례 연장됐으며, 오는 7월 말에 나올 예정이다.
반면 라이답은 FDA와 식약처부터 각각 2017년 2019년에 승인된 FLT3 돌연변이 AML 환자 대상 1세대 화학요법제다. 사실상 현재까지 해당 적응증 대상 유일한 2세대 표적항암제인 조스파타가 라이답 보다 완전관해(CR)율이 높은 것으로 평가되고 있다.









![[포토]이보미,오랜만에 쉽지않네](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110900387t.jpg)
![[포토] 이대한 '오늘 홀인원 한 볼입니다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110900174t.jpg)
![[포토]박현경,반가운 시선](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110900018t.jpg)
![[포토] 가축분 고체연료 협약 인사말하는 김준동 남부발전 사장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110801640t.jpg)
![[포토] 장유빈 '정교함까지 장착한 장타자'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110800230t.jpg)
![[포토]예결위 전체회의, '답변하는 한덕수 국무총리'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110801228t.jpg)
![[포토]난방용품 바라보는 소비자](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110701539t.jpg)
![[포토]트럼프 대툥령 당선에 환율 1400대 돌입 임박](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110701513t.jpg)
![[포토] 장동규 '강한 임팩트를 구사'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110700185t.jpg)

!['낭만의 차' 픽업트럭의 시대…'新시장' 도전장 낸 차는[이車어때]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24110900153h.jpg)
![[포토]첫 홀 출발하는 임희정](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24110900651h.jpg)
![평생 달리다 늙으면 굶어죽는 경주퇴역마…“경찰기마대도 학대 당해”[댕냥구조대]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24110900339b.jpg)

