[이데일리 강민구 기자] 최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와 달리 질병 표적 유전자를 영구 교정하는 암, 유전 질환 치료제로 주목받지만, 몸속에서 암 조직으로 전달 효율과 효능이 낮다는 한계가 있었다.
한국과학기술원(KAIST)은 정현정 생명과학과 교수 연구팀이 이러한 한계를 극복하는 항암 신약을 개발했다. 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 몸속 표적 조직에 특이적으로 전달한 결과, 유전자 교정과 항암 효능을 보였다.
 | | 정현정 KAIST 생명과학과 교수.(사진=KAIST) |
|
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 면역 부작용, 발암성 등 한계가 있다. 비 바이러스성 전달 방법으로 단백질 기반 크리스퍼 기술 전달은 본래 표적과는 다른 분자를 저해하거나 활성화하는 효과를 가져오는 효과가 최소화되며, 안전성이 높아 치료제로 개발하기 좋다.
하지만 크리스퍼 단백질은 분자량이 커 전달체에 탑재하기 어렵고, 전달체의 세포 독성 문제도 있었다.
이에 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 결합하고, 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 이후 개량한 단백질을 난소암을 표적할 수 있는 항체와 결합시켜 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체를 만들었다.
또 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포, 동물모델에서 암세포 특이적으로 세포 내 전달하는 부분을 확인했다. 세포주기를 관장하는 PLK1 유전자 교정을 통해 항암효과도 높게 나타났다.
정현정 교수는 “크리스퍼 단백질과 항체를 결합해 암세포 특이적으로 전달하고, 항암 효능을 보였다”라며 “앞으로 몸속 전신 투여를 통한 유전자 교정 치료와 다양한 암종에 적용하는 플랫폼 기술로 기대하고 있다”라고 말했다.
연구 결과는 국제학술지 ‘어드밴스드 사이언스(Advanced Science)’에 지난 달 29일 온라인 게재됐다.
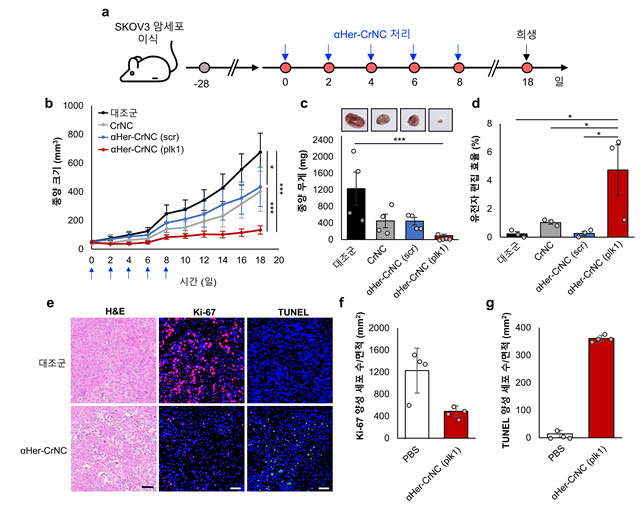 | | 쥐의 난소암 모델에서 항암 효능 검증 실험 모식도.(자료=KAIST) |
|











![[포토] 원·달러 환율 오를까?](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900849t.jpg)
![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)
![[포토] 주식시장 활성화 테스크포스-경제계 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900547t.jpg)
![[포토]최재해, '정치적 탄핵 매우 유감...자진 사퇴 생각 없다'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900431t.jpg)
![[포토]'모두발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900370t.jpg)
![[포토]이데일리 퓨처스포럼 송년회 무대](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801622t.jpg)
![[포토]용산국제업무지구 개발계획 공동협약식에서 협약서 서명](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801123t.jpg)
![강 건너고 짐도 나르고…‘다재다능’ 이상이의 무한변신 차는[누구차]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24113000131h.jpg)


![선도지구 탈락 지역, 행정소송 가능할까?[똑똑한 부동산]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24113000125h.jpg)