[이데일리 김지완 기자]
바이오리더스(142760)가 개발중인 신종 코로나바이러스 감염증(코로나19) 치료제 ‘BLS-H01’의 2상 임상시험용 의약품 위탁 생산계약을 ‘제뉴원사이언스(구 사명 : 한국콜마)’와 체결하고 본격 생산에 돌입한다고 18일 밝혔다.
 | | 바이오리더스 홈페이지. (갈무리=김지완 기자) |
|
바이오리더스(142760)는 지난달 22일 식품의약품 안전처로부터 중등증 코로나19 환자 대상 2상 임상시험 계획을 승인받았다. 이번 계약으로 양산 부산대병원, 가천의대 길병원 등 3개 기관에서 진행되는 임상2상에 필요한 임상시험용 의약품의 안정적인 공급이 가능해졌다.
‘BLS-H01’의 2상 임상시험은 병원 입원이 필요한 중등증 COVID-19 환자를 대상으로 투약된다. 특히 렘데시비르 또는 팍스로비드 등의 항바이러스 표준치료제와 함께 병용해 2상 임상시험을 진행하도록 승인돼 환자모집 및 임상 진행 속도에 이점이 있을 것으로 보인다.
2상 임상시험을 추진중인 바이오리더스의 ‘BLS-H01’은 COVID-19 변이 바이러스 유형에 관계없이 작용하는 면역조절 기반 치료제다. ‘BLS-H01’의 핵심물질인 폴리감마글루탐산(감마-PGA)은 선천성 면역의 주축을 이루는 자연살해세포(NK-Cell : Natural Killer Cell)를 활성화 시킨다. 또 면역세포로부터 인터페론베타 등의 면역매개 물질의 분비를 촉진시켜 탁월한 항바이러스 기능을 발휘하는 기전의 물질이다. 특히 정맥주사나 피하주사 방식이 아닌 입으로 먹는 경구투여 방식의 약물이어서 편의성이 높다.
바이오리더스 관계자는 “임상시험용 의약품은 ‘제뉴원사이언스’에서 생산하지만 임상시험약의 핵심 원료인 감마-PGA는 독보적인 생산 기술력을 갖춘 바이오리더스의 익산 공장에서 직접 생산, 공급하게 된다”며 “이번 계약으로 임상시험용 의약품의 안정적 공급 기반이 확보돼 임상시험에 속도를 낼 수 있게 됐다. 이를 바탕으로 향후 유효성, 안전성 결과를 확보해 긴급승인 신청을 목표로 하고 있다.”고 밝혔다.








![[포토]긴급현안질의, '답변하는 박안수 육군참모총장'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120500534t.jpg)
![[포토]서울 지하철, '계엄 파문 속' 3년 연속 파업](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120500482t.jpg)
![[포토]최고위, '모두발언하는 박찬대 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120500479t.jpg)
![[포토]최고위, '모두발언하는 한동훈'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120500432t.jpg)
![[포토]골프존 파스텔 합창단,지역주민위한 공연](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400127t.jpg)
![[포토]국회 월담하는 우원식 국회의장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401332t.jpg)
![[포토]'규탄사하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401162t.jpg)
![[포토]비상계엄 해제 후 한자리에 모인 한덕수 총리와 국무위원들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401092t.jpg)
![[포토]최상목 경제부총리, '어두운 표정'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400960t.jpg)
![[포토]청사들어서는 한덕수 총리](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400786t.jpg)



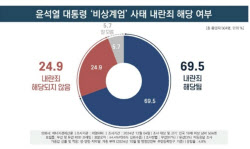
![국민 10명 중 7명 尹 탄핵 찬성…부산·대구에서도 60% 이상[리얼미터]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120500353h.jpg)
