|
국산 코로나 백신
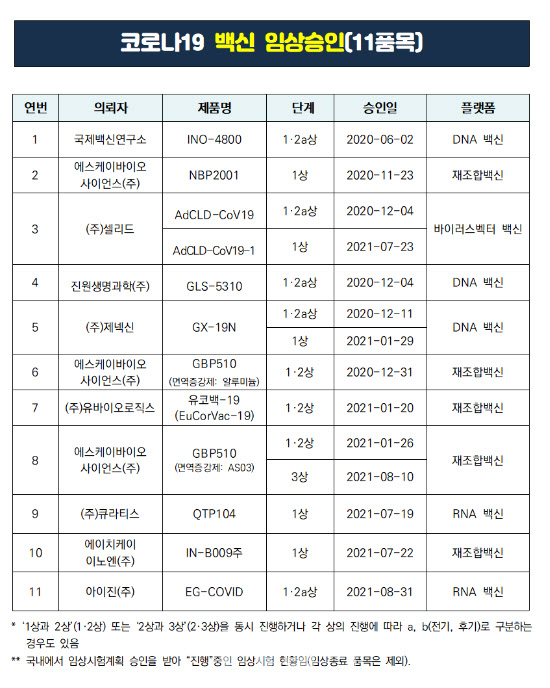
권준욱 중앙방역대책본부 제2부본부장은 지난 23일 정례 브리핑을 통해 “국내에서 개발 중인 메신저리보핵산(mRNA) 기반 코로나19 백신 2종이 임상 1상에 진입했다”며 “국립감염병연구소에서 중화항체 분석을 수행 중”이라고 밝혔다. mRNA 백신은 몸 안에서 항원 단백질을 만들 수 있는 mRNA를 주입하는 방식을 말한다. mRNA는 일종의 설계도로 체내 단백질 생산 체계에 따라 하나의 분자로 여러개의 단백질을 생산 할 수 있어 백신의 생산과 전달 면에서 효율적이라는 평가를 받는다. 아이진(185490), 큐라티스가 이 방식으로 백신을 개발 중이다.
이 외에 합성항원(재조합) 백신 1종이 임상 3상, 합성항원 백신 1종·DNA 백신 2종·바이러스전달체(바이러스벡터) 백신 1종이 임상 2상, 합성항원 백신 2종·바이러스전달체 백신 1종이 임상 1상을 각각 진행 중이라고 전했다.
바이러스전달체 백신은 항원 단백질의 염기서열을 가진 DNA를 인체에 무해한 껍질로 감싸 주입, 체내에서 항원 단백질을 생산하는 방식이다. 셀리드(299660)가 이 방식으로 개발 중이다. 또 DNA 기반 백신은 진원생명과학(011000), 제넥신(095700)이 개발하고 있다.
한미약품 항암신약
특히 NRAS 변이 흑색종 19명 환자 중 5명(26.3%)이 부분 반응(PR)을 보였고, 8명(42.1%)이 안정병변(SD)에 도달했다. 부분 반응을 보인 환자는 모두 과거 면역억제 치료 이력이 있었다는 전언이다. 무진행생존기간(PFS)의 중간값은 7.3개월이었다. 부분 반응 환자 5명 중 4명을 포함한 환자 9명은 분석 시점 기준 투약을 진행 중이었다. 최장 반응 지속기간은 18개월 이상이다.
포지오티닙의 경우 글로벌 2상 중 네 번째 환자군(코호트 4)의 추가 임상 결과가 발표됐다. 비소세포폐암 환자 대상의 글로벌 2상은 총 7개 환자군으로 나뉘는데 이번 연구는 과거 치료 이력이 없는 HER2 엑손 20 삽입 변이 환자(코호트 4)가 대상이다.
스펙트럼이 포지오티닙(16mg)을 하루에 한번 경구 투여해 독성에 따른 용량 중단과 감소를 허용하며 24개월간 환자 상태를 추적 관찰하는 방식으로 임상을 진행한 결과 총 48명의 환자에서 객관적반응률(ORR)은 44%, 이중 1명의 환자는 비소세포폐암의 완전관해(CR)를 보였다. 88%를 차지하는 42명의 환자는 종양 감소효과를 보였고 질병통제율(DCR)은 75%였다. 반응지속기간(DoR)의 중앙값은 5.4개월이었으며, 무진행생존기간(PFS) 중간값은 5.6개월로 나타났다.








![[포토]박찬대 “감액 예산안, 법정시한인 내일 본회의 상정”](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100294t.jpg)
![[포토]짙은 안개에 갇힌 도심](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100227t.jpg)

![[포토] 원·달러 환율 오를까?](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900849t.jpg)
![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)
![[포토] 주식시장 활성화 테스크포스-경제계 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900547t.jpg)
![[포토]최재해, '정치적 탄핵 매우 유감...자진 사퇴 생각 없다'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900431t.jpg)
![[포토]'모두발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900370t.jpg)



!["양육은 예스, 결혼은 노" 정우성 사는 강남 고급빌라는[누구집]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120100093h.jpg)
![`백투더 1998` 콩라면 26년만에 돌아온 까닭은 [먹어보고서]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120100051h.jpg)