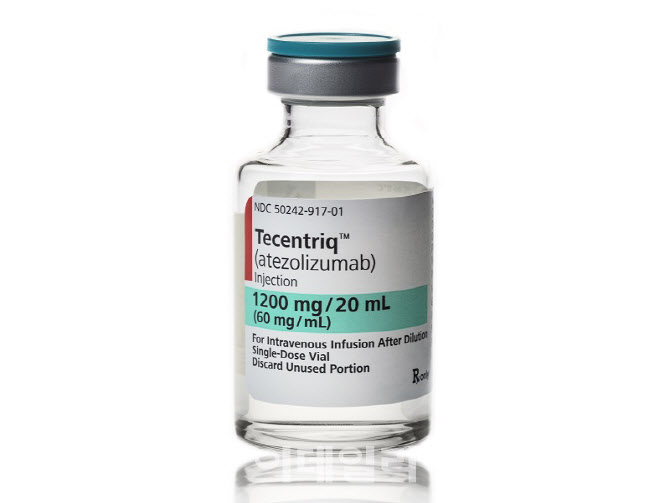
이번에는 스위스 로슈의 면역항암제 ‘티쎈트릭’(성분명 아테졸리주맙)이다. 2020년 기준 글로벌 시장 매출액은 약 29억 달러(당시 한화 약 3조4200억원)로 전체 의약품 중 매출 38위를 기록한 블록버스터다.
|
티쎈트릭의 성분인 아테졸리주맙은 일부 암세포나 조혈모세포 표면에 있는 단백질인 ‘프로그램된 세포 사멸 단백질 리간드1’(PD-L1)을 타깃하는 단일클론항체다.
미국 식품의약국(FDA)이 2016년 5월 아테졸리주맙을 백금화학요법를 받은 뒤 질병 진행이 있는 국소 진행성 또는 전이성 요로상피암 치료제로 승인했다. FDA는 같은 해 아테졸리주맙에 대해 비소세포폐암(NSCLC) 적응증을 추가 승인했다. 로슈는 이를 진행 과정에서 해당 약물의 제품명을 티쎈트릭 공표한 바 있다.
FDA는 2019년 티쎈트릭에 대해 PD-L1이 발현하는 절제 불가능한 국소 진행성 및 전이성 삼중음성유방암(TNBC) 적응증과 성인 확장기 소세포폐암(SCLC) 적응증을 차례로 확대 승인했다. FDA는 2020년 5월 로슈의 또다른 항암제 ‘아바스틴’(성분명 베바시주맙)과 티쎈트릭을 병용투여하는 간세포암 적응증을 승인했고, 2달 뒤인 7월에는 전이성 흑섹종 등의 적응증도 추가로 허가했다.
이를 바탕으로 현재 티쎈트릭은 미국과 유럽연합(EU), 한국 등 세계 각국에서 최소 5종에 고형암종에 두루 쓰인다. 여기에는 앞서 말한 요로상피암, 비소세포폐암(NSCLC), 삼중음성유방암(TNBC), 소세포암(SCLC), 간세포암 등이 포함된다.
특히 지난 5월 FDA가 간세포암 대상 티쎈트릭과 아바스틴을 병용요법이 해당 질환의 치료옵션 중 가장 효과가 뛰어나다고 발표하면서 주목받았다. 이를 통해 간세포암 환자의 1차치료제로 두 약물의 함께 사용할 것을 권고했다. 티쎈트릭과 아바스틴 병용요법이 해당 질환의 기존 1차 치료제로 널리 쓰여 온 독일 바이엘의 ‘넥사바’(성분명 소라페닙)보다 우수한 효능을 인정받은 것이다.
이 밖에도 로슈는 티쎈트릭의 매출을 늘리기 위해 각국에서 여러 약물과 병용 임상을 시도하고 있다. 국내 업체 중에서는 네오이뮨텍(950220)이 개발 중인 T세포 증폭제 신약 후보물질 ‘NT-I7(성분명 에피넵타킨 알파)와 티쎈트릭을 비소세포폐암(임상 2상) 및 고위험 피부암(임상 1/2상) 등을 대상으로 병용 투여하는 임상 2건도 진행하고 있다.










![[포토]12월 LPG 국내 프로판 가격 인상](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100332t.jpg)
![[포토]초코과자 가격 상승](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100324t.jpg)
![[포토]점등 앞둔 사랑의 온도탑](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100312t.jpg)
![[포토]박찬대 “감액 예산안, 법정시한인 내일 본회의 상정”](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100294t.jpg)
![[포토]짙은 안개에 갇힌 도심](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100227t.jpg)

![[포토] 원·달러 환율 오를까?](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900849t.jpg)
![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)



![‘엔화 강세’가 촉발한 달러 약세…환율 1390원대 지속[외환브리핑]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120200119h.jpg)
![반백년 두 가정 두고 살아온 할아버지의 상속 고민, 결국[별별법]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120200075h.jpg)