항체 바이오의약품 전문 제약회사 프레스티지바이오파마는 26일 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)로부터 유방암과 전이성 위암치료제 허셉틴(성분명 트라스투주맙) 바이오시밀러 ‘투즈뉴’(Tuznue)에 대해 유럽 품목 허가 ‘승인 권고’(Positive opinion)를 받았다고 밝혔다.
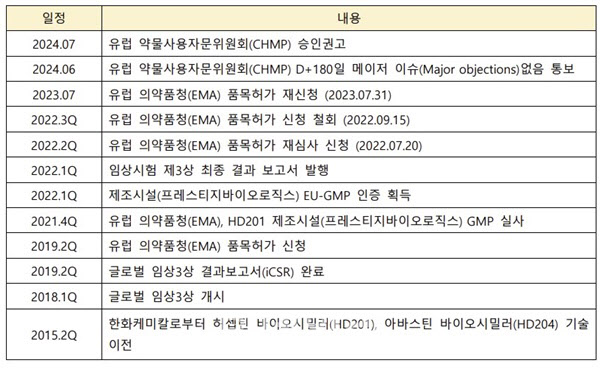
블록버스터 항암제인 허셉틴 관련 시장은 연 5.5조원에 달한다. 이번 CHMP의 판매 승인 권고에 따라 허셉틴 바이오시밀러 ‘투즈뉴’는 오는 10월부터 유럽연합집행위원회(EC)의 허가를 받고 유럽 30개국에 진출할 수 있게 됐다. 국내에서는 셀트리온, 삼성바이오에피스에 이은 세번째 성적이다.
현재까지 바이오시밀러가 유럽 시장의 벽을 넘은 회사는 전세계 단 32곳, 이중 항체의약품 바이오시밀러로 허가를 받은 회사는 20곳이다. 프레스티지바이오파마는 전세계 수백만개의 제약바이오 기업 중 항체의약품 바이오시밀러를 유럽에 출시한 스물한번째 기업이 됐다.
|
10여년간 우여곡절, 시장 우려에도 허셉틴 시밀러 승인 목표 달성
인수 후 2018년 초부터 1년간 글로벌 임상 3상을 진행했으며, 2019년 4월 글로벌 임상3상 결과보고서(iCSR) 및 유럽 의약품청(EMA) 품목허가 신청을 완료했다. 또한 생산을 담당하는 바이오의약품 위탁개발생산(CDMO) 계열사 프레스티지바이오로직스도 2022년 2월에 HD201의 제조 시설 및 공정, 품질관리 시스템에 대한 EU-GMP 인증을 획득한바 있다.
하지만 회사는 일부 임상배치와 상용화배치 간 동등성 분석 기준에 대한 이견으로 2022년 9월에 품목허가 신청을 자진 철회했다. 이때 업계와 시장에서는 우려와 불신의 시각이 교차했지만, 박소연 프레스티지바이오파마 회장을 필두로 임직원들은 꿋꿋하게 본업에 충실하며, 승인만을 목표로 움직였다.
유럽의약품청(EMA) 의견을 기반으로 해당 이슈에 대한 두가지 분석 시험을 추가로 진행했고, 결국 2023년 7월 HD201에 대한 품목허가 재신청을 완료했다.
|
유럽 30개국 진출이어 마일스톤도 유입
‘투즈뉴’는 파이프라인명인 HD201로 더 잘 알려져 있다. HD201은 개발 당시 닥터레디스, 타북, 씨플라, 파마파크 등 글로벌 제약기업과 파트너 라이선스 아웃을 체결했다. 최종 판매 승인 획득 즉시 이에 따른 마일스톤을 수령해 첫 매출이 발생한다. 투즈뉴의 본격적인 유럽 시장 판매를 위한 유럽 파트너 계약 협의도 순항 중이다. 최근 글로벌 제약사들의 러브콜이 이어지고 있어 마케팅 능력과 유통망을 갖춘 파트너와의 판매 라이선스 아웃 계약체결을 통해 시장에 빠르게 침투한다는 전략이다.
프레스티지바이오파마는 기계약된 파트너사들 및 신규 유럽 파트너사와 협의해 투즈뉴 초도 물량을 확정한 이후 즉각 생산에 돌입할 수 있도록 준비 작업을 시작했다. 회사는 이미 EU-GMP를 획득하고 싱글유즈 기반의 최첨단 공정을 갖춘 생산전진기지 프레스티지바이오로직스(334970)를 통해 가격경쟁력의 우위를 확보한 바 있다. 아울러 투즈뉴의 품목허가로 계열사인 프레스티지바이오로직스의 본격적인 매출 시현도 가속화될 것으로 기대된다.
프레스티지바이오파마 박소연 회장은 “이번 투즈뉴의 유럽 허가 권고는 그룹의 첫번째 매출 뿐 아니라 HD204 등 후속 파이프라인의 신속한 품목허가를 위한 귀중한 경험과 전략의 원천이 됐다”며, “글로벌 기준에 부합하는 바이오시밀러를 개발하고 생산하는 기업으로서의 지위를 확보한 만큼 향후 가격경쟁력을 바탕으로 한 공격적인 성장전략으로 시장점유율을 높여갈 것”이라고 말했다.









![[포토] '금융권 공감의 장' 인사말하는 이병래 회장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600936t.jpg)
![[포토]경북 국립의대 신설 촉구, '참석자들에게 인사하는 한동훈'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600846t.jpg)
![[포토]손태승 전 회장, 영장실질심사 출석](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600794t.jpg)
![[포토]정윤하 등장](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600056t.jpg)
![[포토]내년에 또보자 가을](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600715t.jpg)
![[포토]민주당 민생연석회의 참석하는 이재명 대표](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600655t.jpg)
![[포토] '소상공인 힘보탬 프로젝트' 발표](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600583t.jpg)
![[포토]정부, 국무회의에서 세번째 `김여사 특검법` 거부권 건의 의결](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112600579t.jpg)
![[포토] 이즈나 데뷔](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500181t.jpg)
![[포토]첫 싱글 '라스트 벨'로 돌아온 TWS](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112500118t.jpg)




![“270만원 화웨이 신상폰 살 수 있어요?” 中매장 가보니[르포]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112601335h.jpg)