식품의약품안전처와 산업통상자원부 국가기술표준원은 29일 “체외진단 검사기기에 사용되는 유전자 증폭 방식의 감염병 진단기법에 관한 국제표준 개발을 주도하고 있다”며 이같이 밝혔다.
|
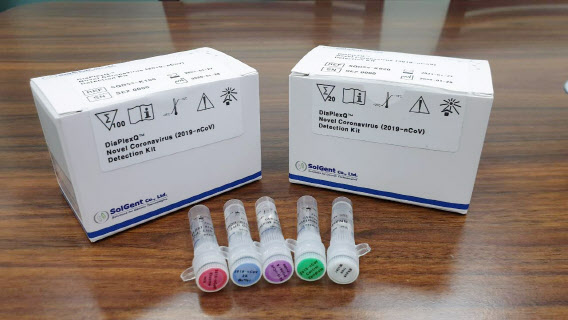
‘유전자 증폭 검사기법’에 대한 국제표준안(案)으로 승인된 `미생물 병원체 검출을 위한 유전자 증폭 검사기법`은 다양한 감염병 진단에 활용할 수 있는 ‘핵산 증폭 방식 체외진단 검사’에 대해 전체 절차 및 방법을 정의했다. 국내에서 코로나19 진단에 이용하고 있는 진단키드에 채택된 ‘실시간 유전자 증폭 기법(Real Time Polymerase Chain Reaction·RT-qPCR)’ 등 핵산 증폭 방식의 검사에 적용할 수 있는 표준이다.
‘유전자 증폭 검사법’ 국제표준은 우리나라 국가표준 전문위원회 심의를 거쳐 지난 2016년 국제표준화기구에 국제 표준안으로 제시됐다. 그동안 미국·유럽·일본 등 세계 각국 국제표준화기구 기술위원들과 긴밀히 협력해 국제표준화 논의를 이끌어온 결과, 첫 제안 이후 4년 만인 올해 2월 국제표준안(DIS) 투표를 회원국 전원 찬성으로 통과시켰다.
|
이미 국내 진단키트 기업의 세계시장 공략은 본격화하고 있다. 이원다이애그노믹스(EDGC) 체외진단 의료기기 자회사인 EDGC(245620)헬스케어는 관계사 솔젠트의 코로나19 진단시약 구매의향서(LOI)를 미국 뉴욕·네바다·캘리포니아 등 주정부와 체결했다. 규모는 약 100만명 분량이다. 또 블라디미르 젤렌스키 우크라이나 대통령 요청을 받은 솔젠트는 우크라이나에 코로나19 진단키트 10만 명분을 수출한다.
외교 경로를 통해 진단키트 수입 관련 문의를 하거나 요청한 국가는 51개국, 인도적 지원을 문의한 곳은 50개국에 달한다.
식약처와 기술표준원 관계자는 “우리가 보유한 코로나19 진단 역량이 세계 각국 관심을 받고 있는 상황에서 이번 국제표준안 확정은 한국 감염병 진단기기를 향한 국제사회 신뢰를 높일 것”이라며 “국내 기술로 개발된 진단키트가 성공적인 시장 진출을 거쳐 향후 글로벌 표준으로 자리매김한다는 점에서 의의가 크다”고 평가했다.









![[포토]골프존 파스텔 합창단,지역주민위한 공연](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400127t.jpg)
![[포토]'규탄사하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401162t.jpg)
![[포토]비상계엄 해제 후 한자리에 모인 한덕수 총리와 국무위원들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401092t.jpg)
![[포토]최상목 경제부총리, '어두운 표정'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400960t.jpg)
![[포토]청사들어서는 한덕수 총리](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400786t.jpg)
![[포토] 대통령실 입구의 취재진](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400817t.jpg)
![[포토]'긴급 의원총회 참석하는 추경호 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400571t.jpg)
![[포토]'긴박했던 흔적들'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400485t.jpg)
![[포토]조국, '국가 비상사태 만든 이는 尹...탄핵해야'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400366t.jpg)
![[포토]尹, '비상 계엄 해제할 것'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400277t.jpg)




