에스티큐브는 면역관문억제제 ‘hSTC810’의 임상 1상 시험계획(IND)이 식품의약품안전처 승인을 받았다고 16일 밝혔다.
‘hSTC810’은 에스티큐브가 세계 최초로 발견한 면역관문억제제 후보물질이다. 암세포 표면 단백질인 PD-L1의 상위 조절자 ‘BTN1A1’을 타겟으로 한다.
진행성 고형암을 대상으로 ‘hSTC810’ 단독 요법의 안전성, 내약성, 약동학 및 예비 유효성을 확인하고 최대 내성 용량 및 최대 투여 용량을 결정한다.
회사 관계자는 “지난 1월 미국 식품의약국(FDA)의 IND 승인으로 ‘hSTC810’에 대한 다국적 제약사의 관심이 커진 상황이고 이미 다수의 제약사와 비밀유지계약(CDA)를 맺고 실사가 진행 중이다. 비임상 데이터에 상응하는 결과가 도출된다면 기술이전 가능성도 빨라질 것으로 기대된다”고 전했다.
정 대표는 이어 “’hSTC810’은 기존 면역항암제 치료에 불응하는 환자들에게 유용한 치료제로서 면역항암제 개발 분야의 게임 체인저가 될 것”이라고 덧붙였다.
|









![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)

![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)
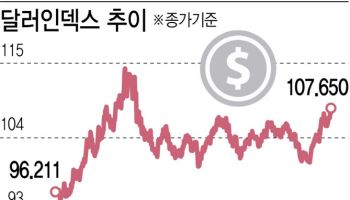

!["앞으로 이만한 것 없다"…15조 뭉칫돈 몰린 '이 펀드' [마켓인]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122300619h.jpg)