19일 업계에 따르면 셀트리온은 최근 자체개발 1호 바이오시밀러 ‘램시마’의 미국 식품의약국(FDA) 허가를 신청했다. 유럽, 캐나다, 일본 등 주요 선진 의약품 시장에서 시판허가를 받은 데 이어 미국 시장 진입도 초읽기에 들어간 셈이다. 램시마는 얀센의 류마티스관절염치료제 ‘레미케이드’를 본따 만든 제품으로 지난 2012년 세계 최초의 항체 바이오시밀러로 허가받았다.
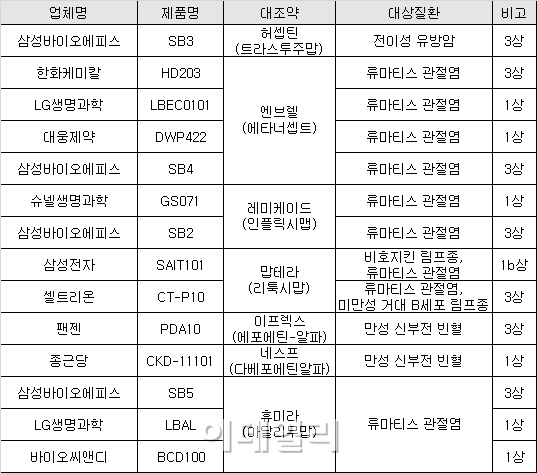
셀트리온은 램시마 이외에도 2개의 바이오시밀러 라인업을 보유하고 있다. 이미 지난 1월 두 번째 바이오시밀러 ‘허쥬마’의 국내 시판승인을 받았고, 이달 초 류마티스관절염 치료제 ‘맙테라’의 복제약 개발을 위한 임상3상시험에 돌입했다.
삼성, LG, 한화 등 대기업들이 셀트리온을 추격하고 있지만 아직 격차가 크다. 현재 셀트리온을 제외하고 시판허가를 받은 바이오시밀러 제품은 1개도 없다.
셀트리온에 이어 상품화 단계에 가장 근접한 제품은 한화케미칼(009830)의 ‘HD203’이다. 화이자의 ‘엔브렐’과 같은 성분의 이 제품은 지난 2012년 9월 모든 임상시험을 완료하고 허가가 신청돼 지난해 승인이 유력했지만 서류상 미비점이 발견돼 허가가 보류됐다.
삼성의 추격도 만만치 않다. 삼성의 바이오시밀러 연구·개발을 담당하는 삼성바이오에피스는 현재 총 4개의 바이오시밀러를 개발 중이다. 셀트리온에 비해 개발 속도는 더디지만 품목 수는 1개 더 많다
삼성바이오에피스는 유방암치료제 ‘허셉틴’, 류마티스관절염치료제 ‘엔브렐’·‘레미케이드’·‘휴미라’ 등 수조원 규모의 대형 제품들을 본따 만든 바이오시밀러에 대해 모두 상품화 마지막 단계인 임상3상시험을 진행하고 있다.
이중 ‘엔브렐’과 ‘레미케이드’의 바이오시밀러의 경우 각각 지난해 7, 8월에 임상3상시험에 착수, 이르면 내년 시판승인이 가능할 전망이다.
이밖에 대웅제약, 슈넬생명과학 등이 항체 바이오시밀러의 임상시험에 착수했지만 아직 초기 단계에 머물고 있다.
업계 한 관계자는 “바이오시밀러는 수조원 규모의 해외 시장이 타깃이고, 글로벌제약사들도 개발에 진전을 보이고 있어 시장 진입 순서가 경쟁력과 직결된다”고 말했다.
|
▶ 관련기사 ◀
☞[마감]코스닥, 개인 '사자'에 사흘째 상승..560선 회복
☞셀트리온, 종합인플루엔자 항체신약 임상 성공
☞[마감]코스닥, 이틀째 쌩쌩..외국인 '사자'








![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)

![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)


