|
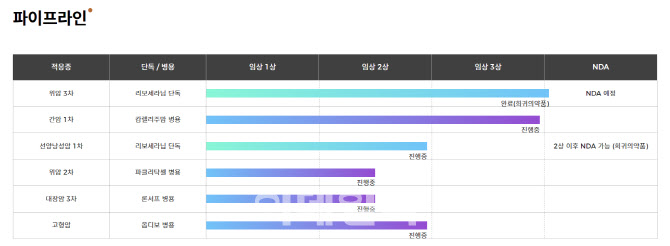
HLB가 처음 FDA에 신약허가를 신청하겠다고 공언한 시점은 2019년이다. HLB는 2019년 말 리보세라닙을 위암 3·4차 치료제로 이듬해(2020년)까지 NDA를 신청하겠다고 발표했다. 이는 진양곤 HLB 회장이 리보세라닙이 위암치료제 임상에서 1차 지표의 유효성은 미충족했지만 기타 지표들은 탁월했다고 판단한 데 따른 것이다. 당시 진 회장은 “임상학적 유의미성을 충분히 확보해 신약허가를 신청해 볼 만 하다”고 했다.
해당 임상 결과 1차 지표인 전체생존기간(OS)은 5.79개월로 대조군(사이람자 5.2개월, 론서프 5.7개월, 옵디보 5.3개월)보다 높게 나타났지만 위약 대조군의 OS도 5.13개월이라 통계적 유의성을 얻지 못했다. 2차 지표인 무진행생존기간(PEF)은 2.83개월로 대조군(사이람자 2.1개월, 옵디보 1.6개월, 론서프 2개월)과 위약군보다 뛰어났다.
리보세라닙의 위암 치료제 NDA 신청은 FDA에서 OS가 미충족된 것에 대해 보완을 요구하면서 미뤄졌다. 이에 대해 HLB 측은 “만약 임상이 실패했거나 NDA 신청이 불가능했다면 FDA가 보완자료 요청을 하지도 않았을 것”이라고 설명했다. HLB는 지난해 항서제약으로부터 외부 데이터를 수령해 FDA가 요구한 자료 보완을 완료한 상태다.
이후 HLB는 리보세라닙의 적응증을 간세포암, 선낭암 등으로 넓혀 임상을 진행했다. 현재는 위암 외에도 간세포암, 선낭암 등에 대해 동시다발적으로 NDA 신청 준비를 하고 있다. HLB는 지난해 간세포암, 선낭암 중 어느 적응증이든 연내에 NDA를 1건 신청하기로 했지만 결국 또 신청 예정 기한이 올해로 미뤄졌다.
|
현재 가장 빠르게 NDA 신청이 예상되는 적응증은 간세포암이다. 지난해 하반기까지만 해도 선낭암 NDA 신청이 가장 빠를 것으로 예상됐지만 FDA의 추가 자료 요청으로 인해 간세포암이 앞지르게 됐다. HLB는 항서제약과 함께 오는 5월까지 간세포암 병용임상 결과를 바탕으로 FDA에 품목허가신청서를 제출할 예정이다. 리보세라닙은 중국 NMPA로부터 2020년 12월 간세포암 2차 치료제로 허가받은 데 이어 지난달 1일에는 간세포암 1차 치료제로 승인받았다.
HLB는 리보세라닙과 항서제약의 면역항암제 ‘캄렐리주맙’을 간암 1차 치료제로 병용 임상을 진행했다. 해당 글로벌 임상 3상 결과, 환자전체생존기간 중앙값(mOS)은 22.1개월로 대조군인 소라페닙(15.2개월)보다 길었다. 무진항생존기간의 중앙값(mPFS)은 5.6개월로 대조군 3.7개월보다 길었다. 객관적반응률(ORR)은 병용요법이 25%, 대조군 6%였다.
단독 치료제 NDA는 위암 or 선낭암…고민 중
최근 HLB는 리보세라닙의 선낭암과 위암 중 어느 쪽의 NDA를 먼저 진행할지 고민 중이다. FDA 규정상 단독 임상 요법의 동일 약물에 대한 NDA는 2건 이상 동시에 진행할 수 없기 때문이다. 병용 임상의 경우에는 별도로 NDA를 신청할 수 있다.
위암의 경우 2019년 임상 3상을 마쳤지만 1차 유효성 지표에 도달하지 못했기 때문에 FDA를 설득하기 쉽지 않을 것으로 예상된다. 선낭암의 경우 임상 2상을 완료해 위암보다는 임상 단계가 낮지만, 신약 허가에 유리한 측면도 있다. 선낭암은 아직 표준치료제가 없어 혁신신약(First-in-class)이 될 가능성이 높고, 시장 진입 시 약가 책정에 유리할 것으로 기대된다.
이 때문에 최근 HLB는 선낭암 NDA를 우선순위에 두고 NDA 준비를 진행 중이다. HLB는 지난해 말 선낭암 NDA 제출을 위한 준비를 모두 마쳤지만, FDA가 리보세라닙의 적절한 투여 용량을 뒷받침한 추가 자료를 요구했다. 이에 따라 엘레바는 임상 3상에 투여할 용량의 적합성을 입증하기 위한 모델링(Modeling & Simulation) 분석에 착수했다. 해당 분석을 마치고 나면 위암과 선낭암 중 어느 쪽 데이터가 더 우수한지 분석해 둘 중 유리한 적응증으로 NDA를 제출하겠다는 게 HLB의 계획이다.
HLB 관계자는 “올해 5월에는 간세포암 치료제로 리보세라닙 NDA를 신청하기로 FDA와 협의가 된 상태”라며 “겉으로만 보면 몇 개월 이상 NDA가 지연되는 걸로 볼 수도 있겠지만 내부적으로는 FDA와 가능성을 타진하면서 계속 다양하게 준비하고 있다”고 말했다.








![[포토] 맘스홀릭베이비페어 전시](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010901108t.jpg)
![[포토]수도권 첫 한파주의보](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010901027t.jpg)
![[포토]'무죄'받고 이동하는 박정훈 전 수사단장](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010900998t.jpg)
![[포토]기자회견 하는 김상욱 의원](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010900987t.jpg)
![[포토]전국정당을 넘어 K-정당으로 향하는 더불어민주당](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010900948t.jpg)
![[포토]발언하는 권영세 위원장](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010900599t.jpg)
![[포토]포즈 취하는 팀테일러메이드](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010800134t.jpg)
![[포토]서울 올겨울 첫 한파특보… 내일 체감온도 영하 17도](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010800820t.jpg)

![[포토] 김혜수, 나홀로 화보](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010800074t.jpg)
![[포토]홍재경 아나운서,론칭쇼 진행합니다](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2025/01/PS25010800229h.jpg)



