|
29일 식품의약품안전처 및 의약품통합정보시스템 ‘의약품안전나라’를 보면, 코로나19 관련 임상시험은 현재 11건이 신청됐다.
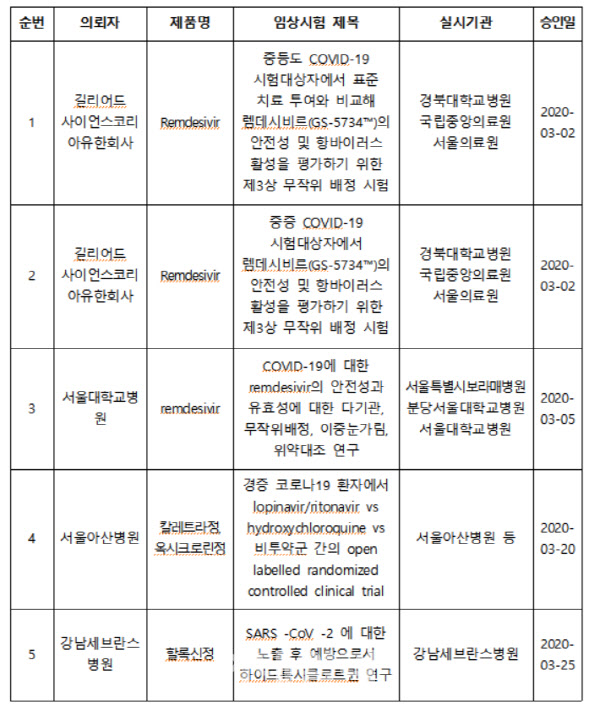
이 중 26일 기준으로 대한감염학회·대한항균요법학회 등 전문가 자문을 거쳐 5건이 승인됐다.
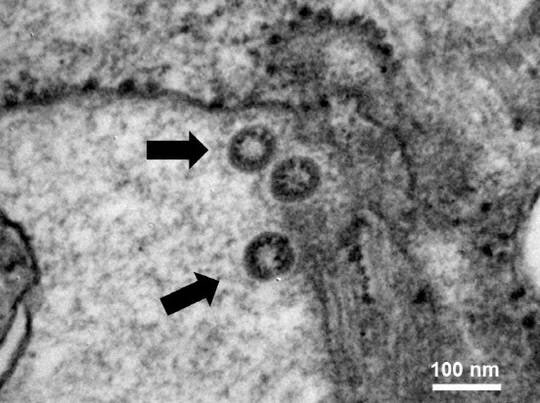
우선 에볼라 치료제인 ‘렘데시비르’ 관련 임상시험 3건이 승인됐다. 길리어드의 한국법인인 길리디어사이언스코리아가 임상시험 계획을 의뢰한 것이 2건으로 모두 임상 3상이다.
1건은 중등도(중간) 환자를 대상으로 표준 치료 투여와 비교해 렘데시비르의 안전성 및 항바이러스 활성을 평가하기 위한 제3상 무작위 배정 임상 시험이다.
목표시험 대상자수는 중증도 환자 120명의 국내 환자를 포함해 600명이며 현재 환자를 모집중이다. 임상시험 기간은 이달부터 오는 12월까지다.
길리어드는 또 중증 코로나 환자 400(국내 환자 75명 포함)을 대상으로 렘데시비르의 안전성 및 항바이러스 활성을 평가하기 위한 제3상 무작위 배정 시험에 나선다.
렘데시비르 임상은 서울대병원이 의뢰한 1건이 또 있다. 국내 환자 100명을 포함해 394명을 대상으로 하는 임상 2상이다.
코로나19 환자에 대한 렘데시비르의 안전성과 유효성을 보는 임상으로 보라매병원, 분당서울대병원, 서울대병원에서 진행된다. 임상시험 기간은 이달부터 2023년 3월까지다.
또다른 에이즈 치료제인 ‘칼레트라정’과 말라리아 치료제 ‘히드록시클로로퀸정’ 관련 임상시험 1건도 승인됐다.
마지막으로 현재 승인된 코로나19 치료제 임상은 강남세브란스병원에서 말라리아 치료제 ‘히드록시클로로퀸정’의 코로나19 노출 후 예방 효과를 확인하는 임상 1건이다.
코로나19 확진자 접촉후 72시간이 경과하지 않은 내국인 2486명을 대상으로 진행하는 연구자임상시험이다. 이달부터 내년 3월까지 진행된다.
식약처는 또 인플루엔자 치료제로 임상시험 중인 의약품을 코로나19 치료 목적으로 사용할 수 있도록 ‘치료목적 사용승인’으로 신청된 6건을 승인했고 10건은 검토 중에 있다.
승인된 6건은 모두 6건 국내 바이오벤처 이뮨메드의 ‘HzVSFv13주’다. 이뮨메드는 HzVSFv13주을 투여한 중증 환자 5명이 완치했다고 주장하는 것으로 알려졌다.
하지만 식약처 관계자는 “HzVSF 외 다른 치료도 함께 받았기 때문에 HzVSF의 효능 때문인지는 아직 알 수 없다”고 말했다.
|







![[포토]골프존 파스텔 합창단,지역주민위한 공연](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400127t.jpg)
![[포토]'규탄사하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401162t.jpg)
![[포토]비상계엄 해제 후 한자리에 모인 한덕수 총리와 국무위원들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120401092t.jpg)
![[포토]최상목 경제부총리, '어두운 표정'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400960t.jpg)
![[포토]청사들어서는 한덕수 총리](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400786t.jpg)
![[포토] 대통령실 입구의 취재진](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400817t.jpg)
![[포토]'긴급 의원총회 참석하는 추경호 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400571t.jpg)
![[포토]'긴박했던 흔적들'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400485t.jpg)
![[포토]조국, '국가 비상사태 만든 이는 尹...탄핵해야'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400366t.jpg)
![[포토]尹, '비상 계엄 해제할 것'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400277t.jpg)


![[속보]한동훈 “대통령 탈당 다시 요구…제가 책임지고 사태 수습”](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120500324b.jpg)

![[속보]추경호 “尹대통령 탄핵 반드시 부결시킬 것”](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120500336h.jpg)