|
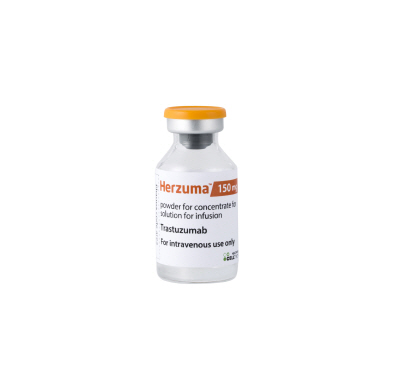
셀트리온은 14일(현지 시간) 미국 식품의약국(FDA)으로부터 트라스투주맙 바이오시밀러 ‘허쥬마’의 판매 허가를 획득했다고 15일 밝혔다.
허쥬마의 오리지널의약품은 스위스 로슈가 판매하는 ‘허셉틴’(성분명 트라스투주맙)이다. 허셉틴은 지난해 글로벌 시장에서 74억3500만달러(약 8조4240억원) 어치가 팔렸고, 미국에서만 연간 약 5조원 규모의 매출이 나오고 있다. 셀트리온은 미국에서 허셉틴의 물질특허가 만료되는 내년 6월 이후 제품을 출시할 것으로 보인다.
셀트리온은 허쥬마를 지난달 29일 허가받은 바이오시밀러 ‘트룩시마’에 이어 제3의 ‘램시마’로 키운다는 계획이다. 지난 2012년 세계 최초의 항체 바이오시밀러 램시마를 식품의약품안전처에서 허가 받은 이후 램시마·트룩시마·허쥬마 등 3개 바이오시밀러의 미국 허가 승인은 셀트리온의 중장기 목표 중 하나였다. 서정진 셀트리온 회장은 올해 2월 이탈리아 베니스에서 개최한 ‘2018 셀트리온헬스케어 인터내셔널 써밋’에서 “올해는 램시마·트룩시마·허쥬마를 세계 시장에 선보이는 원년이 될 것”이라며 기대감을 보이기도 했다.
셀트리온은 시장에 성공적으로 자리잡은 램시마에 이어 트룩시마와 허쥬마 등 3종의 바이오시밀러를 통해 글로벌 시장을 선도하겠다는 포부다. 이미 유럽에서 지난해 4월 출시한 트룩시마는 네덜란드와 영국에서 각각 점유율 66%, 56%를 기록하며 빠른 성장세를 보이고 있다. 또 허쥬마도 지난 2월 유럽 의약품청(EMA) 허가를 통해 유럽에서 먼저 출시하면서 시장 점유율을 높이고 있다. 지난 6월 네덜란드에서 출시해 주요 입찰 경쟁에서 승리한 데 이어 연간 관련 시장 규모가 3500억원에 달하는 프랑스에서도 병원연합체 입찰기관과 잇따라 허쥬마의 납품 계약을 체결했다. 셀트리온은 미국에서도 이 같은 상승세를 이어갈 것으로 기대하고 있다.
브랜던 오그래이디 테바 북미사업 부문장은 “허쥬마 허가를 통해 바이오시밀러 경쟁에서의 입지를 넓히는 데 무척 고무되어 있다”며 “의약품 포트폴리오에 허쥬마를 포함하면서 항암 및 복제약 두 분야 모두에서 우리의 강점을 활용할 수 있게 됐다”고 말했다.
기우성 셀트리온 대표는 “미국 유방암 환자들의 삶의 질 제고에 기여할 수 있어 무척 기쁘게 생각한다”며 “유럽 등에서 많은 처방 데이터로 입증한 당사 바이오시밀러에 대한 신뢰를 미국 시장에서도 확인할 수 있기를 고대하고 있다”고 말했다.








![[포토]'긴급 의원총회 참석하는 추경호 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400571t.jpg)
![[포토]'긴박했던 흔적들'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400485t.jpg)
![[포토]조국, '국가 비상사태 만든 이는 尹...탄핵해야'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400366t.jpg)
![[포토]尹, '비상 계엄 해제할 것'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120400277t.jpg)
![[포토]코스피-코스닥 동반 상승 마감](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300908t.jpg)
![[포토]따스한 온기를 퍼지는 행복촌](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300829t.jpg)
![[포토]이웃을 위한 연탄나눔봉사활동](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300804t.jpg)
![[포토]한동훈, '여성의 힘으로 세상을 바꾸자'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300792t.jpg)
![[포토]설영희부띠끄 24W/25S 살롱 패션쇼](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300633t.jpg)
![[포토]유승민 "대한체육회장 공식 출마합니다"](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300064t.jpg)




