|
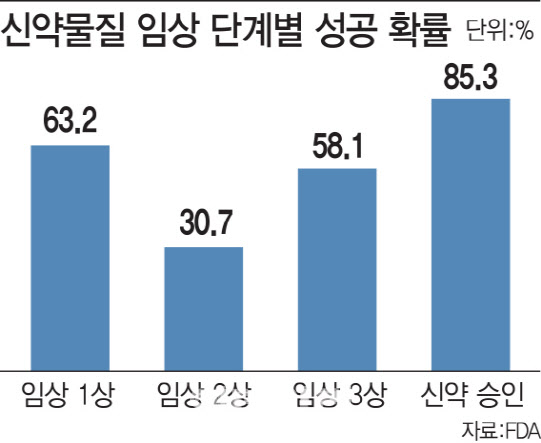
SK투자증권에 따르면 2006년부터 2015년까지 지난 10년간 FDA 임상에서 임상 1상에서 신약 승인까지 모두 통과할 확률은 평균 9.6%다. 90%이상이 실패한다는 얘기다.
임상 1상의 통과 가능성은 63.2%다. 1상은 소수의 건강한 성인을 대상으로 치료 후보물질의 독성 등 안정성을 평가하는 단계다.
임상 2상은 임상 단계 중에서 가장 낮은 30.7%다. 100~300명의 환자를 대상으로 최적의 투여량 등과 용법을 평가하는 단계다.
통상 1000~3000명의 환자를 대상으로 약물 유효성과 안전성을 최종 검증하는 임상 3상은 성공률이 58.1%다.
임상 3상을 끝내고 이후 품목 허가를 받는 과정(NDA)을 통과할 확률은 85.3%로 임상 각 단계에서 가장 높다.
하나투자증권에 따르면, 렘데시비르는 미국에서 초기 코로나19 바이러스 확진자가 발생했을 때 동정사용(compassionate use)에서 단기간 내에 환자의 상태가 개선되면서 세계보건기구(WHO)가 가장 기대하고 있는 치료제 후보물질이다.
동정사용은 치료제가 부재한 상황에서 그 적응증에 승인받지 않은 의약품을 실험적으로 처방하게 하는 제도다.
선민정 하나투자증권 연구원은 “수많은 임상들이 진행되고 있지만 이 중 기업이 스폰서인 것은 길리어드가 임상을 수행 중인 렘데시비르 임상 2건이 거의 유일하다”고 말했다.
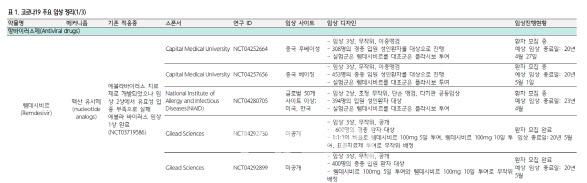
이 임상 2건은 임상 사이트(실시 병원)가 공개되지 않았다. 하나는 600명의 경증 환자를 대상으로 하는 임상 3상이다. 환자모집은 완료됐고 오는 5월에 임상이 끝난다.
다른 한 건은 400명의 중증 입원 환자를 대상으로 한 임상 3상이다. 역시 환자 모집이 끝났고 5월에 임상이 종료된다.
길리어드가 스폰서가 아닌 다른 임상까지 포함하면 렘데시브르 임상은 현재 임상 2상과 임상 3상이 진행 중이다.
지난 FDA에서의 각 단계별 성공확률에 근거해 단순 계산하면 임상 2상에서 시작해 최종 품목 허가 승인을 받을 확률은 15% 정도다.
임상 3상에서 시작해 최종 품목 허가를 승인받을 확률은 50%정도다.
|








![[포토] 서울역 환승센터](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112800768t.jpg)
![[포토] '질퍽거리는 눈 피해서'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112800590t.jpg)
![[포토]이재명, 한국거래소 찾아 국내 주식시장 활성화 논의](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112800462t.jpg)
![[포토]국민의힘 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112800406t.jpg)
![[포토] 오세훈 서울시장, '리더는 세상을 어떻게 바꾸는가'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112700981t.jpg)
![[포토]서울에 117년만에 폭설](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112700882t.jpg)
![[포토] 휘슬러x구세군 사랑샘 자선냄비 체험관 전달식](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112700766t.jpg)
![[포토]격차해소특별위원회 정책토론회 '정년연장 쟁점과 과제'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112700657t.jpg)
![[포토]박찬대, '군주민수'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112700587t.jpg)
![[포토]발렌타인 글렌버기 스몰배치 16년 출시](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112700578t.jpg)




