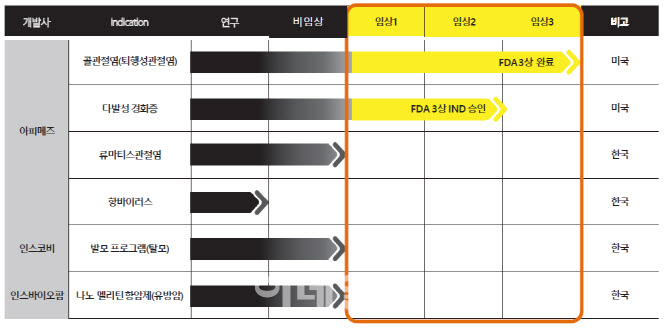
인스코비(006490)는 16일 다발성 경화증 치료제 후보물질 ‘아피톡스’의 미국 임상 3상 비용마련을 위한 투자금 유치 계약이 막바지에 있다고 밝혔다. 인스코비는 지난 2018년 6월 FDA로부터 골관절염 치료제 ‘아피톡스’를 다발성 경화증으로 적응증 확대를 위한 3상 임상시험계획(IND)을 승인받았다.
|
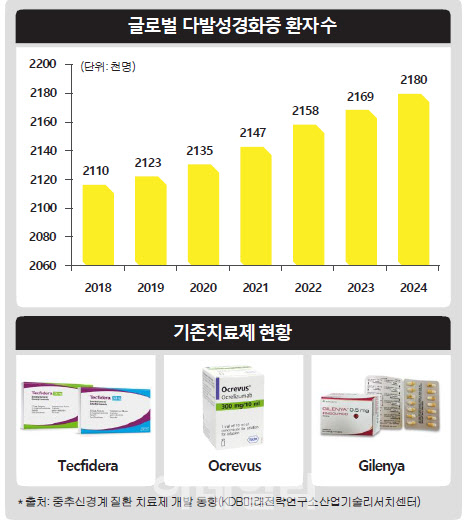
다발성 경화증은 자가면역반응 이상으로 신경세포가 죽어 운동장애를 일으키는 질환이다. 증세는 △안구 통증이 동반된 시력이상 △저린감·화끈거림 등의 감각이상 △우울증·기억력 저하 등 인지기능장애 △반신마비·하반신바비·사지마비 등 운동장애 △배뇨·배변·성기능장애 등 몸에 다양한 증상이 나타난다. 전 세계 약 250만명의 다발성 경화증 환자가 있으며. 주로 젊은 연령층과 여성에게 많이 나타난다.
돌발 변수 없다면, 연내 美 임상 3상 개시
아피톡스의 미국 임상 3상 비용은 600억~700억원이 필요할 것으로 추산된다. 인스코비는 미국 임상 비용 마련을 위해 지난해 초 미국 현지 법인 ‘아피메즈’(Apimeds)를 설립하고 현지 투자은행(IB) ‘머독캐피탈’과 파트너십을 체결했다. 이어 지난해 12월 미국 가치평가 기관인 ‘엔터프라이즈 밸류’(Enterprise Value Advisor)로부터 기업가치를 9억1000만달러(1조400억원)로 평가받고 투자금 유치에 나섰다.
아피톡스는 지난 2003년 식품의약품안전처로부터 허가받은 천연물신약 1호, 국내 신약 6호 골관절염 전문의약품이다. 인스코비는 2009년부터 2016년말까지 아피톡스를 골관절염 적응증으로 미국 1·2·3상 임상을 차례로 진행했다. 하지만 글로벌 골관절염 치료제 시장이 포화상태였고, 낮은 약가로 최종 품목허가까지 진행하지 않았다.
대신 약가가 높은 다발성 경화증 치료제 개발로 방향을 틀었다. ‘봉독’을 기반으로 고가인 여타 자가면역질환 치료제로 적응증 확대까지 염두에 뒀다. 인스코비는 아피톡스의 동물 임상에서 다발성 경화증에 대한 유효성을 증명했다. 골관절염 적응증과 동일한 약물 농도로 FDA로부터 임상 1·2상을 면제받았다.
“임상 성공에 자신 있어...시장 경쟁력도 충분하단 판단”
글로벌 대표 자가면역질환 치료제인 애브비(Abbvie)의 휴미라, 얀센(Janssen)의 레미케드, 화이자(Pfizer) 엔브헬 등은 모두 ’TNF-α‘를 억제하는 방식이다.
|
인스코비 관계자는 “멜리틴은 동물실험에서 이미 다발성 경화증 치료에 유효성 효과를 증명했고, 골관절염 미국 임상에서 안전성이 완벽하게 증명됐다”면서 “또 지난해 말부터 가톨릭 대학교 연구진과 세포시험을 비롯한 기초 연구를 통해 또 다른 자가면역질환인 류마티스 관절염에도 효과가 있다는 게 확인됐다”고 강조했다.
그는 “종전 다발성 경화증 치료제가 연 6000만~7000만원의 고가로 환자 부담이 컸다”면서 “또 케미컬 성분 특성상 투여 환자 대상이 제한됐다. 치료 후에도 다수의 재발환자가 발생하는 등 효과가 제한적이었다”고 지적했다. 이어 “반면 아피톡스는 천연물 치료제로 기존 화학 치료제 보다 싸고 부작용이 적다”면서 “또 사용 대상에 제한이 덜하다”고 비교했다.
그는 임상 3상이 성공적으로 마무리된다면 아피톡스가 다발성 경화증 치료제 시장에서 글로벌 시장 점유율 20~30%를 차지할 수 있을 것으로 내다봤다. 인스코비는 아피톡스가 다발성 경화증 적응증 임상에 성공하면 FDA 희귀의약품 승인을 추진할 계획이다. 한편, 시장조사기관 데이터모니터는 올해 글로벌 다발성 경화증 시장을 235억달러(28조원) 규모로 추산했다.








![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)
![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)