|
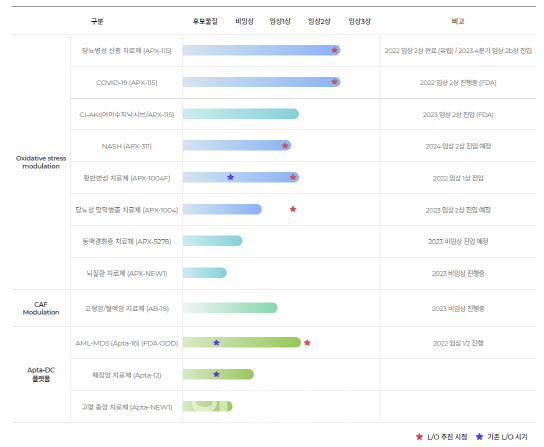
압타바이오는 급성신장손상(CI-AKI) 치료제 ‘아이수지낙시브’(APX-115)의 임상 2상을 본격적으로 시작한다고 지난 12일 밝혔다.
압타바이오는 아이수지낙시브에 대해 지난 1월 미국 식품의약국(FDA)과 5월 국내 식품의약안전처로부터 조영제 유발 급성신장손상 임상 2상 IND 승인을 받은 바 있다. 임상 시험은 한국과 미국 약 15개 기관에서 진행될 예정이며 국내에서는 삼성서울병원 등 13개 병원이 확정됐다.
임상시험 실시기관별 조영제신독성 임상에 대한 심의 종료 후 환자 모집 및 투약이 진행된다. 10월 10일 첫 번째 임상시험 실시기관의 환자 모집을 개시했으며, 병원별로 순차적으로 모집이 시작돼 본격적인 투약이 진행될 예정이다.
임상시험은 경피적 관상동맥 시술을 받은 약 200명의 환자를 대상으로 ‘아이수지낙시브’ 투약이 이뤄진다. 압타바이오는 환자에 시험약 또는 위약 400㎎을 5일간 투약 후 12주 동안 추적 조사를 진행해 ‘아이수지낙시브’의 급성신장손상에 대한 안전성 및 유효성을 평가한다. 임상시험은 2024년 말 종료를 목표하고 있다.
이수진 압타바이오 대표는 “이번 첫 병원의 임상 개시를 시작으로 ‘아이수지낙시브’의 임상 2상이 본격적으로 시작될 것”이라고 말했다.
아이진은 자체 기술로 개발한 코로나19 예방 mRNA 다가백신 ‘EG-COVII’(이지-코브투)의 임상 1/2a상 시험계획서를 호주 임상시험윤리위원회에 제출했다고 지난 10일 공시했다.
아이진의 코로나19 예방 다가백신 EG-COVII 호주 임상 1/2a상은 코로나19 부스터 접종 여부 및 접종 횟수와 관계없이 현재 시판 중인 코로나19 예방 백신을 접종한 건강한 성인 임상 참여자들에게 EG-COVII를 3주 간격 2회 투여 후 6개월의 관찰 기간을 거쳐 안전성과 내약성 및 면역원성에 관한 평가를 진행한다.
1상은 10명, 2a상은 30명의 임상 참여자를 대상으로 EG-COVID 및 EG-COVARo를 각 400㎍씩 혼합해 총 800㎍의 용량으로 투여할 계획이다.
EG-COVII는 코로나19 와일드 타입(우한종)을 타깃한 백신 ‘이지-코비드’ (EG-COVID)와 오미크론 변이를 타깃한 백신 ‘이지-코바로’(EG-COVARo)를 결합한 mRNA 다가(2가) 백신이다. 보건복지부 산하 한국보건산업진흥원 지원 ‘다가 코로나19 예방 mRNA 백신개발’ 국가 과제를 통해 2년간 총 130억원 규모의 사업비 중 정부로부터 100억원을 지원받아 연구 개발을 진행하고 있다.
아이진 관계자는 “코로나19 예방 mRNA 다가백신은 최근에도 출현하고 있는 코로나 변이 바이러스에 대응할 수 있을 뿐 아니라 향후에 변이 발생이 빈번한 독감과 같은 바이러스성 감염증 등 다양한 감염증의 예방 백신 개발에도 적용이 가능할 것” 이라고 설명했다.
에이비온이 비소세포폐암 치료제 ‘ABN401’의 글로벌 임상 2상을 진행하고 있는 가운데 신규지원 과제에 선정됐다고 지난 10일 밝혔다.
에이비온은 국가신약개발재단(KDDF)에서 주관하는 ‘2023년 제3차 국가신약개발사업 신약 임상개발 신규 지원 과제’에 최종 선정됐다. 이번 과제는 2년간 총 70억원의 과제규모로 지원되며 회사는 ‘ABN401’의 후속 임상 2b상 시험 계획(IND) 승인 또는 기술이전을 목표로 한다.
에이비온의 ‘ABN401’은 c-MET 돌연변이를 타깃하는 비소세포폐암 치료제다. 현재 한국과 미국, 대만에서 글로벌 임상 2상을 진행하고 있다.
‘ABN401’은 임상 1상을 통해 우수한 안전성을 입증했으며, 글로벌 임상 2상은 c-MET 돌연변이 중 Exon14 유전자 결실 환자군을 대상으로 진행하고 있다. 지난 상반기 초기 투약한 환자들에게서 부분관해(PR)와 안전성을 확인됐다.
에이비온은 ‘ABN401’에 대해 지난 2018년 4월부터 1년 6개월간 보건복지부로부터 7억원을 지원받아 비임상 연구과제를 수행한 바 있다. 이후 2020년에는 글로벌 임상 1상 연구에도 보건복지부 과제로 21억원을 지원받아 성공적인 임상 결과를 얻는 등 지속적인 관심을 받아왔다.
에이비온 관계자는 “ABN401의 글로벌 임상 2상 진행에 대한 지원과제에 선정된 만큼 성공적인 결과를 얻을 수 있도록 최선을 다할 것”이라고 말했다.








![[포토]코스피-코스닥 동반 상승 마감](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300908t.jpg)
![[포토]따스한 온기를 퍼지는 행복촌](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300829t.jpg)
![[포토]이웃을 위한 연탄나눔봉사활동](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300804t.jpg)
![[포토]한동훈, '여성의 힘으로 세상을 바꾸자'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300792t.jpg)
![[포토]설영희부띠끄 24W/25S 살롱 패션쇼](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300633t.jpg)
![[포토]유승민 "대한체육회장 공식 출마합니다"](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300064t.jpg)
![[포토]더불어민주당 원내대책회의](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300465t.jpg)
![[포토]'모두발언하는 추경호 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120300359t.jpg)

![[포토]의정갈등에 피해는 환자에게…](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120200764t.jpg)




