16일 식품의약품안전청의 생동인정품목현황에 따르면, 지난 2001년 생동성시험제도 도입 후 지금까지 총 6443개의 제네릭이 식약청으로부터 생동성을 인정받았다.
제네릭 허가를 위해서는 오리지널 의약품과의 동등성을 입증하는 생물학적동등성시험을 통과해야 한다. 지난 2001년 생동성시험 제도가 생긴 이후 6444개 품목이 오리지널과의 동등성을 인정받고 시장에 진입한 셈이다.
|
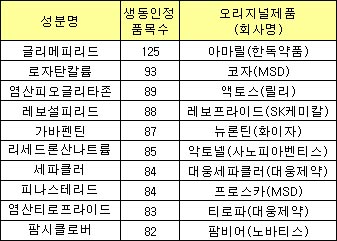
성분별 생동성 인정 현황을 살펴보면 국내제약사들은 특정 분야 제네릭 개발에 집중했다.
한독약품(002390)의 당뇨병치료제 `아마릴`이 오리지널인 `글리메피리드` 성분의 경우 총 125개 품목의 제네릭이 시장에 진입했다.
지난 2009년 기준 식약청으로부터 GMP 인증을 받은 업체가 242곳임을 감안하면 제약사 2곳중 1곳은 아마릴 제네릭을 보유하고 있다는 의미다.
MSD의 고혈압치료제 `코자` 제네릭은 93개 품목이 식약청으로부터 허가받았다.
`염산피오글리타존`, `레보설피리드`, `가바펜틴`, `리센드론산나트륨`, `세파클러`, `피나스테리드`, `염산티로프라이드`, `팜시클로버` 등도 허가받은 제네릭 품목 수가 80개가 넘었다.
한정된 시장에 제네릭의 무더기 출시로 업체간 제살 깎아먹기 경쟁을 펼치면서 제약사들이 불법 리베이트가 만연할 수밖에 없는 구조를 자초하고 있다는 분석이다.
또 많게는 품목당 1억원에 달하는 생동시험비용의 중복 투자로 사회적 낭비가 발생하고 있어 제네릭 시장의 과열경쟁을 차단할 대책 마련이 시급하다는 지적도 제기된다.
▶ 관련기사 ◀
☞식약청, 천연물신약 활성화 나섰는데 `할일이 태산`








![[포토]은행권 소상공인 금융지원 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300609t.jpg)
![[포토]인사청문회 출석한 마은혁 헌법재판관 후보자](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300404t.jpg)
![[포토]아침 영하 10도, 꽁꽁 얼어붙은 도심](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300843t.jpg)
![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)



