|
지난 25일 서울 강남구 제테마 본사에서 만난 김재영 대표는 “우리는 균주 기원 논란에서 자유롭다”고 강조했다. 이 회사는 지난 2016년 영국 공중보건국(PHE. Public Health England)으로부터 이 기관이 보유한 보툴리눔톡신 ‘ATCC3502’ 균주와 이 균주의 상용화 권리를 넘겨 받았다. PHE가 연구용으로 보툴리눔 균주를 유출한 적은 있었지만 상용화 권리를 넘긴 것은 제테마와의 계약이 유일하다. 그해 가을 국내에서는 메디톡스(086900)와 대웅제약(069620) 간의 균주 기원 논쟁이 벌어졌고 이후 보툴리눔 톡신 사업에 진출한 국내 업체들 간에 균주 기원 논란이 수년째 지속되고 있다. 이에 대해 김 대표는 “해외에 진출하려면 기원이 명확한 균주가 필요했다”며 “다양한 경로를 찾다 보니 합법적으로 균주를 확보할 수 있는 방법이 있다는 것을 알게 됐다”고 말했다. 제테마는 오는 8~9월 경에 PHE에서 받아 상용화 준비 중인 균주의 DNA 전체 염기서열 분석 결과를 공개할 예정이다. 제테마가 PHE로부터 받은 균주가 ATCC3502가 맞다는 것을 확인하는 작업이다.
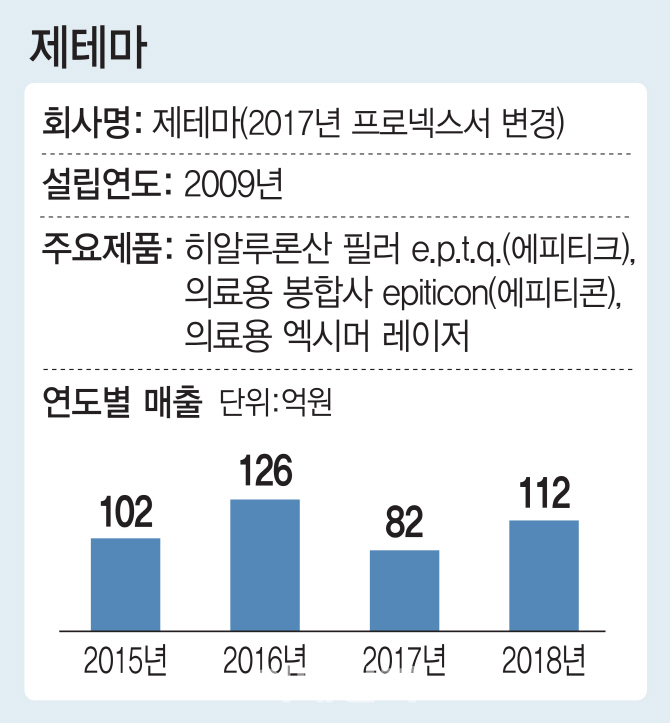
제테마는 히알루론산 필러를 주력으로 하던 회사였다. 이 회사가 보툴리눔톡신 시장 진출을 결정한 것은 2015년 경이다. 김 대표는 “미용시장에서 필러와 보툴리눔톡신은 실과 바늘의 관계라 자연스레 보툴리눔톡신에 대해 관심을 갖게 됐다”며 “시장조사를 해 보니 미용시장보다 치료시장 규모가 지속적으로 커지고 있어 승산이 있다고 판단했다”고 진출 배경을 설명했다. 보툴리눔톡신은 다한증, 안검경련, 사시, 뇌성마비, 과민성 방광 등 현재 10개 질환 치료에 허가를 받았으며 우울증, 조루, 골관절염을 대상으로는 임상시험이 진행 중이다.
제테마는 올해 3월 강원도 원주에 보툴리눔톡신 전용 공장을 준공했다. 연간 400만 바이알의 제품을 생산할 수 있는 규모다. 김 대표는 “미국 등 선진시장 진출이 목표인 만큼 미국과 유럽의 기준인 cGMP, EUGMP를 모두 충족한다”며 “미국 식품의약국(FDA) 허가만 받으면 바로 제품을 생산할 수 있는 모든 준비를 마쳤다”고 말했다.
제테마의 보툴리눔톡신 상용화 목표는 2023년이다. 회사 측은 충분히 가능하다는 분석이다. 보툴리눔톡신은 상용화된지 이미 수십년이 지난 만큼 임상경험이 풍부하게 쌓여 있는 상황이다. 그래서 임상시험이 실패할 확률이 적다. 대신 맹독성 균이라 공정관리가 중요하다. 김 대표는 “임상 경험자는 많지만 보툴리눔톡신에 대한 cGMP 경험을 가진 사람은 많지 않다”며 “보툴리눔톡신의 미국 허가 경험이 있는 전문가들이 합류해 있는 만큼 목표는 충분히 달성 가능할 것”이라고 말했다.
제테마는 테슬라 상장(이익미실현기업 상장 특례)을 검토하고 있다. 테슬라 상장은 시가총액 500억원 이상 기업 중 △직전 연도 매출 30억원 이상에 최근 2년간 평균 매출증가율 20% 이상 또는 △공모 후 자기자본 대비 시가총액이 200% 이상인 적자기업이 대상이다. 제테마는 2017년부터 2년 연속 적자를 기록하고 있다. 보툴리눔톡신 전용 공장에 대한 대규모 투자 탓이다. 김 대표는 “보툴리눔톡신 사업에 대한 대규모 투자를 진행하느라 최근 수년간 일시적으로 적자가 발생했지만 상용화하면 이익을 실현할 수 있는 만큼 ‘이익미실현’이라는 테슬라 상장의 취지에 부합한다”며 “테슬라 상장 조건은 충분히 충족한다고 판단한다”고 말했다.
|









![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]영화 속 배경에서 찰칵](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901369t.jpg)
![[포토] 아수라장된 기자회견장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121901115t.jpg)
![[포토]다양한 식음료가 한 자리에, '컬리 푸드페스타 2024'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24121900958t.jpg)
![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)



