|
DMC는 진행 단계의 임상시험에서 환자의 안전과 약물 효능 데이터를 모니터링 하는 전문가 그룹이다. DMC는 생물 통계학자 1명을 포함한 3명에서 7명의 임상 전문가로 구성된다. 이번 신라젠 무용성 평가에는 임상관련 유럽 의사 3명과 통계학자 1명 등 4명이 참여했다.
신라젠 관계자는 “DMC는 임상과정이 길기 때문에 중간 점검의 차원에서 임상 3상에서 꼭 필수적으로 설계해야 하는 위원회”라며 “회사와 실제 임상을 수행하는 임상위탁업체(CRO)등이 협의해 위원회를 구성해 독립적으로 활동한다”고 말했다. 신라젠은 미 식품의약국(FDA)과 임상 설계 과정에서 이미 임상 3상 과정에서 DMC 무용성평가를 받기로 했다. 이번 무용성 평가 결과를 내놓지 않으면 FDA에서 신약 승인을 받을 수 없다는 얘기다.
“신라젠 모든 신약 개발 실패 아냐”
신라젠은 이번 임상 3상 중단으로 큰 타격을 입게 됐다. 신라젠은 사실 2006년 설립된 종원업수 68명의 중소기업이다. 하지만 항암제 신약개발에 대한 기대로 지난 2016년 적자상태에서 ‘기술특례상장’으로 코스닥에 상장해 연초까지만 해도 5조원 넘는 시총 2위 회사였다. 그러다 이번 임상 중단으로 지난 2일 하루만에 시총 1조원 가량이 날아간 상태다. 회사는 나머지 신약 개발에서 승부를 본다는 입장이나 나머지 신약개발도 펙사벡을 기반으로 한 것이라 부정적 영향을 배제할 수 없다.
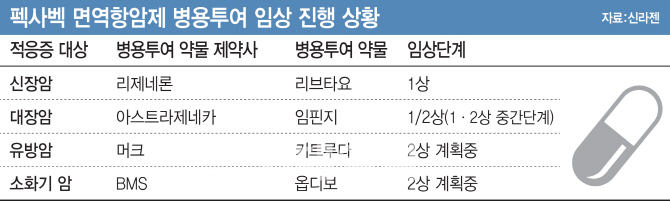
면역항암제 병용·펙사벡 실전요법 임상 공개로 시장 진화
신라젠은 회사의 모든 신약 개발이 실패한 것은 아니라고 강조했다. 임상개발을 총괄하고 있는 권혁산 상무(의사)는 “이번에 조기 종료된 임상은 진행하고 있는 임상 중의 하나일 뿐”이라며 “펙사벡은 ‘물약’(무용한 약)이 아니다”고 말했다. 또한 시장의 각종 의혹도 반박했다. 문은상 대표는 무용성 평가를 회사에서 미리 알고 있었는데 숨긴 거 아니냐는 의혹에는 “임상이 진행하면 회사는 전혀 관여하지 못한다”며 “회사가 관여하려는 것이 발각되는 순간 데이터가 무효화된다”고 강조했다. 그러면서 문 대표는 “DMC에서 왜 중단 권고가 나온지 지금도 잘 모르겠다”며 당혹감을 호소하기도 했다. 무용성 평가 발표 전 신라젠 보유 주식 16만7777주를 4회에 걸쳐 매각한 신현필 신라젠 전무에 대해서는 회사 관계자가 “개인의 일탈 행위로 보고 있다”며 “권고사직을 진행중”이라고 말했다.
회사의 진화에도 K바이오 시장은 단기적 위축이 불가피할 전망이다. 글로벌 임상 3상의 벽을 넘지 못하는 사례가 잇따르고 있어서다. 앞서 지난 6월말에는 또다른 바이오벤처 에이치엘비(028300)가 말기 위암 환자를 대상으로 한 리보세라닙의 글로벌 임상 3상 실패를 알렸다. 코오롱생명과학의 유전자 골관절염 치료제 인보사케이주 역시 ‘성분 은폐’ 논란에 휩싸여 미 식품의약국의 임상 3상이 중단된 상태다.
다만 신약 개발 자체가 글로벌 제약사에도 어려운 일인 만큼 K바이오 전체에 대한 지나친 우려는 좋지 않다는 지적이다. 오기환 한국바이오협회 상무는 “바이러스항암제는 글로벌 신약으로 나온 것이고 새로운 분야라 굉장히 어려운 과제”라며 “임상 실패는 선진(제약)시장으로 가는 성장통으로 이해해야 한다”고 말했다. SK투자증권에 따르면 2006년부터 2015년까지 지난 10년간 FDA에서 진행된 임상에서 임상 3상의 성공률은 평균 58.1%다.









![[포토] 원·달러 환율 오를까?](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900849t.jpg)
![[포토] 폭설 피해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900576t.jpg)
![[포토] 주식시장 활성화 테스크포스-경제계 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900547t.jpg)
![[포토]최재해, '정치적 탄핵 매우 유감...자진 사퇴 생각 없다'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900431t.jpg)
![[포토]'모두발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112900370t.jpg)
![[포토]이데일리 퓨처스포럼 송년회 무대](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801622t.jpg)
![[포토]용산국제업무지구 개발계획 공동협약식에서 협약서 서명](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24112801123t.jpg)
![강 건너고 짐도 나르고…‘다재다능’ 이상이의 무한변신 차는[누구차]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24113000161h.jpg)


![선도지구 탈락 지역, 행정소송 가능할까?[똑똑한 부동산]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24113000125h.jpg)