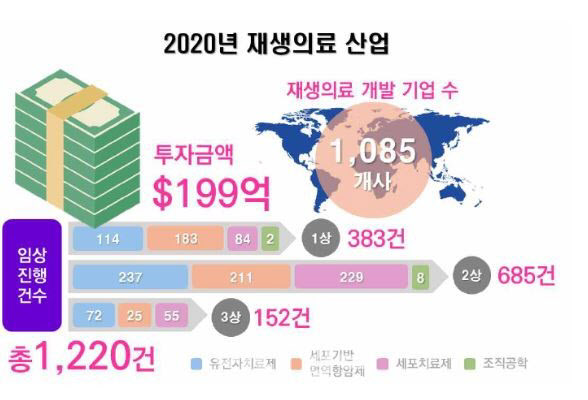
첨단바이오의약품은 세포, 조직, 장기 등의 기능을 복원시키는 의학 분야로 난치성 질환의 치료 대안으로 떠오르고 있다. 줄기세포치료제, 바이오소재, 조직공학, 면역세포치료제, 유전자치료제 분야가 여기에 속한다.
|
미 FDA와 유럽 EMA는 2025년까지 각 기관별 연 10~20건의 세포·유전자 치료제를 승인할 것으로 예상하고 있다. 미국 FDA의 재생의약첨단치료제(RMAT) 지정이나 유럽 EMA의 우선허가심사(PRIME)와 같은 패스트트랙 제도는 파이프라인 개발을 촉진하고 있다.
국내 제 1호 첨단바이오의약품은 노바티스의 카티(CAR-T) 치료제 ‘킴리아주’가 차지했다. 국내 제약사 중에서는 GC녹십자셀이 2007년 항악성종양제인 ‘이뮨셀엘씨주’ 품목허가를 받아 세포치료제 매출 1위를 기록하고 있다. 지난해말부터는 췌장암 신규 적응증 추가를 위해 3상 임상시험을 진행 중이다. 메디포스트 카티스템은 2012년 품목허가를 받았고 국내 치료제 중에서는 유일하게 연매출 100억원을 달성했다. 테고사이언스 칼로덤(사람유래피부각질세포), 코아스템 뉴로나타-알주, 파미셀 하티셀그렘-에이엠아이 등이 국내에서 승인을 받았다. LG화학은 메디포스트의 세포치료제 플랫폼 기술이전을 받아 항암제와 유전자 기술을 적용한 차세대 줄기세포 치료제 개발에 나섰다. 다만 첨단바이오의약품이 개인 맞춤형 의약품인만큼 개발비용이 높고 규제기관의 허가 문턱도 높아 진입장벽이 높은 상황이다.
국내 제약사들은 첨단바이오의약품에 대한 생산 수요가 급증할 것으로 예상, CDMO에 보다 집중하고 있다. 차바이오랩은 첨단재생바이오법 1호 제조업 허가를 받았다. 이밖에도 인체세포등 관리업 허가, 세포처리시설 허가 등 세포·유전자 치료제 생산과 연구·개발에 필요한 3가지 허가를 취득했다.
국내 에스티팜은 세포 치료제 분야 CDMO 사업 확대에 나섰다. 미국 샌디에이고에 RNA(리보핵산) 및 CAR-NKT(키메라 항원 수용체-자연살해 T세포) 신기술 플랫폼을 활용한 신약개발 전문 바이오텍 레바티오 테라퓨틱스를 설립했다. 기존 올리고뉴클레오타이드 및 mRNA 유전자 치료제에서 세포치료제 분야의 신약개발 및 CDMO로 사업을 확대하기 위해서다.
삼성바이오로직스는 항체 의약품 중심의 CDMO 사업 영역을 세포·유전자 치료제, 백신 등 신약 부문으로까지 넓히겠다는 방침을 밝혔다.
국내 첨단바이오의약품 산업은 상대적으로 해외 특허 출원비율이 낮고 영향력이 적어 글로벌 시장에서 경쟁력이 낮은 편으로 분석되고 있다. 한국바이오협회 관계자는 “국내에서도 글로벌 동향을 반영해 첨단바이오의약품의 임상개발과 심사의 신속한 절차를 진행할 수 있도록 패스트트랙 제도를 활성화해 국내 기업들의 연구개발을 촉진할 수 있도록 지원하고, 첨단바이오의약품의 국내외 연구개발 및 생산 수요에 대응하고 해외기업들과 경쟁할 수 있는 국내 CDMO의 역량 강화가 필요하다”고 말했다.








![[포토]은행권 소상공인 금융지원 간담회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300609t.jpg)
![[포토]인사청문회 출석한 마은혁 헌법재판관 후보자](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300404t.jpg)
![[포토]아침 영하 10도, 꽁꽁 얼어붙은 도심](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122300843t.jpg)
![[포토]스케이트 타는 시민들로 북적](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200317t.jpg)
![[포토]기름값 10주째 올라…전국 휘발유 평균 1652.2원](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200258t.jpg)
![[포토]크리스마스 분위기](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122200248t.jpg)
![[포토]'서울광장 스케이트장 좋아요'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000768t.jpg)
![[포토] 나인퍼레이드 캠페인](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000496t.jpg)
![[포토]더불어민주당 최고위원회의 개최](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122000232t.jpg)

![[포토]안소현-김성태 본부장,취약계증 후원금 전달식 진행](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24121400036h.jpg)



